题目内容
12.在一密闭容器中发生反应:xA(g)+yB(g)?zC(g),达到平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器体积缩小到原来的一半,再达到平衡时,测得A的浓度为0.80mol/L.下列判断正确的是( )| A. | 平衡向正反应方向移动 | B. | C的体积分数下降 | ||
| C. | x+y<z | D. | B的转化率降低 |
分析 达到平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器体积缩小到原来的一半,若平衡不移动,则A的浓度为1mol/L,而再达到平衡时,测得A的浓度为0.80mol/L,可知体积减小、压强增大,平衡正向移动,以此来解答.
解答 解:A.由上述分析可知,体积减小、压强增大,平衡正向移动,故A正确;
B.平衡正向移动,C的体积分数增大,故B错误;
C.压强增大,平衡正向移动,则x+y>z,故C错误;
D.平衡正向移动,B的转化率增大,故D错误;
故选A.
点评 本题考查化学平衡移动,为高频考点,把握体积与压强的关系、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意动态变化与静态变化的结合,题目难度不大.

练习册系列答案
相关题目
15.合成导电高分子材料PPV的反应:
 +nCH2═
+nCH2═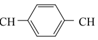 ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI
下列说法正确的是( )
 +nCH2═
+nCH2═ ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
7.
请回答下列问题:
(1)上述四种酸的酸性由强到弱的顺序是H2SO3>CH3COOH>H2CO3>HClO>HCO3-
(2)下列离子方程式正确的是A
A.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-
B.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O.
| 弱酸 | CH3COOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=3.0×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)上述四种酸的酸性由强到弱的顺序是H2SO3>CH3COOH>H2CO3>HClO>HCO3-
(2)下列离子方程式正确的是A
A.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-
B.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O.
17.检验某溶液X中是否含有 Na+、K+、Fe3+、Mg2+、Iˉ、Cl-、CO32ˉ、SO42ˉ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( )


| A. | 溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ | |
| B. | 通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- | |
| C. | 试剂①为硝酸钡溶液 | |
| D. | 通过焰色反应,可确认溶液X中阳离子的种类 |
1.化学用语在化学学习中有着重要的作用.下列有关化学用语使用正确的是( )
| A. | CO2的电子式 | B. | H2O2的电子式 | C. | HCI的电子式 | D. | Cl-的结构示意图  |
17.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1mol化合物X最多能与8mol H2反应 | |
| D. | 在酸性条忤下水解,水解产物只有一种 |
 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题. 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: