题目内容
20. 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:2H++2e-=H2↑
(2)当电极a为Fe、电极b为Cu、电解质溶液为浓硝酸时,该装置能(填“能”或“不能”)形成原电池,若不能,请说明理由,此空不填;若能,请写出该电池负极的电极反应方程式Cu-2e-=Cu2+.
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能.现设计一燃料电池,以电极a为正极,电极b为负极,CH4为燃料,采用酸性溶液为电解液;则CH4应通入b极(填a或b,下同),电子从负极流出.电池的负极反应方程式为:CH4+2H2O-8e-=CO2+8H+.
分析 (1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极上氢离子得电子生成氢气;
(2)自发的氧化还原反应能设计成原电池,失电子的极是负极;
(3)燃料电池中,甲烷燃料通在负极,正极是氧气得电子,电子从负极流向正极.
解答 解:(1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极上氢离子得电子生成氢气,正极的电极反应为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)Fe、Cu、浓硝酸之间.金属Fe遇到浓硝酸会钝化,Cu与浓硝酸反应,则能设计成原电池,失电子的是金属铜,为负极,金属铁为正极,负极反应式为:Cu-2e-=Cu2+;
故答案为:能;Cu-2e-=Cu2+;
(3)氢氧燃料电池中,燃料甲烷需通在负极,正极是氧气得电子,电子从负极流向正极,负极上甲烷失电子生成二氧化碳,则负极电极方程式为:CH4+2H2O-8e-=CO2+8H+;
故答案为:b;负;CH4+2H2O-8e-=CO2+8H+.
点评 本题考查原电池原理,为高频考点,把握原电池的工作原理、正负极的判断和电极方程式的书写方法为解答的关键,侧重电极、电极反应、电子转移的考查,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
3.实验室里需用480mL 0.1mol•L-1的碳酸钠溶液,选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取5.1 g Na2CO3,加入500 mL水 | |
| B. | 称取13.7 g Na2CO3•10H2O,配成500 mL溶液 | |
| C. | 称取5.3 Na2CO3,加入500 mL水 | |
| D. | 称取14.3 g Na2CO3•10H2O,配成500 mL溶液 |
11.化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用
②研发易降解的生物农药
③应用高效洁净的能源转换技术
④田间焚烧秸秆
⑤推广使用节能环保材料.
①加快化石燃料的开采与使用
②研发易降解的生物农药
③应用高效洁净的能源转换技术
④田间焚烧秸秆
⑤推广使用节能环保材料.
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
12.在一密闭容器中发生反应:xA(g)+yB(g)?zC(g),达到平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器体积缩小到原来的一半,再达到平衡时,测得A的浓度为0.80mol/L.下列判断正确的是( )
| A. | 平衡向正反应方向移动 | B. | C的体积分数下降 | ||
| C. | x+y<z | D. | B的转化率降低 |
9.用NA表示阿德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6LO2与5.6LNO混合后的分子总数为0.5NA | |
| B. | 标准状况下,22.4L C6H6分子中含有6NA个C-C单键 | |
| C. | 7.8克过氧化钠中含0.2NA阳离子和0.1NA阴离子 | |
| D. | 在500mL0.1mol•L-1NaAlO2溶液中AlO2-?数为0.05NA |
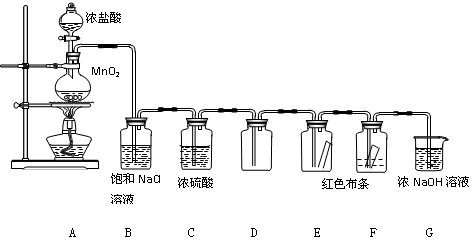
 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
 与足量NaOH溶液反应的化学方程式为CH3CBr(COOH)CH3+2NaOH→CH3C(OH)(COONa)CH3+NaBr+H2O.
与足量NaOH溶液反应的化学方程式为CH3CBr(COOH)CH3+2NaOH→CH3C(OH)(COONa)CH3+NaBr+H2O.