题目内容
【题目】四碘化锡(SnI4)是一种橙红色固体,熔点为144.5℃,沸点为364℃,易水解,易溶于有机溶剂,实验室通过如图所示装置用锡和碘单质制备SnI4,实验步骤如下:
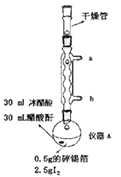
一、洗涤并干燥仪器,然后按照图中标注用量向仪器A中加入各种药品并组装仪器。
二、通入冷凝水,加热仪器A至装置中紫色蒸气消失,溶液颜色由紫红色变为橙红色。
三、停止加热,趁热过滤除去固体杂质,将滤液在烧杯中冷却析出晶体。
四、对所得晶体进行重结晶,过滤、洗涤、干燥、称量。
请回答下列相关问题:
(1)仪器A的名称是__________________,装置中球形冷凝管的作用是__________________,其效果优于直形冷凝管的原因是__________________。
(2)从实验步骤及装置图分析,实验过程中主要目的是防止SnI4水解的操作有___________、_______。
(3)若最终所得晶体的质量为2.2g,则锡的转化率为_______________(保留三位有效数字)。
(4)SnI4遇水发生复分解反应生成一种白色沉淀和一种强酸,检验反应后所得的溶液中的阴离子的常用方法有以下三种,请补充其中所缺试剂。
①沉淀法:稀硝酸和________________;②置换--萃取法;新制氯水和__________________;③利用该元素对应单质的某种特征反应:新制氯水和____________________。
【答案】 圆底烧瓶 冷凝回流 冷凝面积更大 干燥仪器 用冰醋酸和酸酐作溶剂或采用非水溶剂 球形冷凝管上方连接干燥管 69.6% AgNO3溶液 苯或者CCl4 淀粉溶液
【解析】 (1)仪器A的名称是圆底烧瓶,装置中球形冷凝管的作用是冷凝回流易挥发的物质,如醋酸和碘等等,其冷凝面积更大,所以冷凝效果优于直形冷凝管。
(2)从实验步骤及装置图分析,实验过程中主要目的是防止SnI4水解的操作有:干燥仪器、用冰醋酸和酸酐作溶剂(或采用非水溶剂)以及球形冷凝管上方连接干燥管。
(3)最终所得SnI4晶体的质量为2.2g,其物质的量为0.00351mol,原料中0.6g锡的物质的量为0.00504mol,则锡的转化率为![]() 69.6%。
69.6%。
(4)SnI4遇水发生复分解反应生成一种白色沉淀和一种强酸,则该白色沉淀为氢氧化锡、强酸为氢碘酸。检验反应后所得的溶液中的碘离子的常用方法有以下三种:①沉淀法:用稀硝酸和AgNO3溶液检验,若有黄色沉淀生成,则证明有碘离子;②置换--萃取法;用新制氯水和苯或者CCl4检验,方法是先加入少量的氯水,充分反应后再加入少量的苯或四氯化碳,充分振荡后,静置,若有机层显紫色,则证明有碘离子;③利用该元素对应单质的某种特征反应(即碘遇淀粉变蓝):用新制氯水和淀粉溶液检验,若溶液变蓝,则证明有碘离子。

【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。


