题目内容
【题目】全钒电池以惰性材料做电解,在电解质溶液中发生的总反应式为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+ V2+(绿色)+2H+,下列说法正确的是( )
VO2+(黄色)+ V2+(绿色)+2H+,下列说法正确的是( )
A.当电池放电时,VO2+离子被氧化
B.放电过程中,正极附近溶液的pH变大
C.充电时,阳极附近溶液由绿色逐渐变为紫色
D.放电时,负极反应为:VO2+ +2H+ +2e- =VO2+ +H2O
【答案】B
【解析】
A选项,当电池放电时,VO2+离子中钒的化合价降低,被还原,故A错误;
B选项,放电过程中,正极反应式VO2+ +2H+ +2e- =VO2+ +H2O,溶液附近溶液的pH变大,故B正确;
C选项,充电时,阳极化合价升高,附近溶液由蓝色逐渐变为黄色,故C错误;
D选项,放电时,正极反应为:VO2+ +2H+ +2e- =VO2+ +H2O,故D错误。
综上所述,答案案为B。

【题目】有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是( )
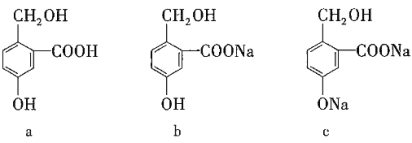
选项 | a转化为b | a转化为c | c转化为b |
A | NaOH | Na | CO2 |
B | Na2CO3 | NaOH | HCl |
C | NaHCO3 | NaOH | CO2 |
D | NaHCO3 | NaCl | HCl |
A.AB.BC.CD.D
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)+Q
CH3OH(g)+Q
32、能判断反应达到平衡状态的依据是(填字母序号,下同)________。
A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
33、下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
34、要提高CO的转化率,可以采取的措施是________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
35.寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。

