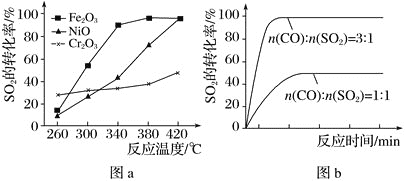
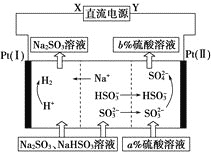
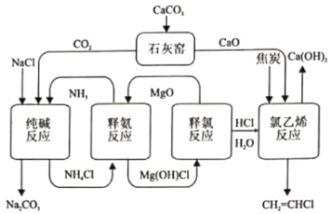
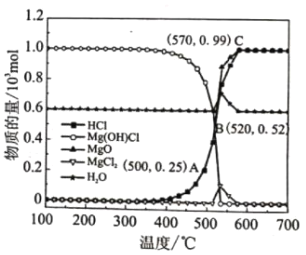
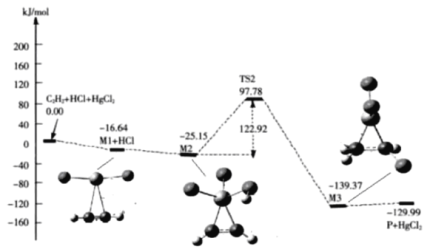
题目内容
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)+Q
CH3OH(g)+Q
32、能判断反应达到平衡状态的依据是(填字母序号,下同)________。
A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
33、下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
34、要提高CO的转化率,可以采取的措施是________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
35.寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
【答案】CD > 80% 250℃ df 选Z,温度要求低,反应速率快
【解析】
32.可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
33.①升高温度,平衡向吸热方向移动,据此分析该反应△H;
②根据平衡时一氧化碳的物质的量,可以计算出其变化量,进而计算出一氧化碳的转化率;根据三段式计算出该反应的平衡常数,找出对应温度;
34.CO(g)+2H2(g)![]() CH3OH(g) △H<0,要提高CO的转化率,则使平衡向正反应方向移动,且不能是增大CO的浓度来改变平衡;
CH3OH(g) △H<0,要提高CO的转化率,则使平衡向正反应方向移动,且不能是增大CO的浓度来改变平衡;
35.因为T1>T2>T3,所以温度越低平衡常数越大,反应物转化率越大,又催化剂同等程度加快反应速率,因此据此可以选出既能在低温下作用又能加快反应速率的催化剂。
32.A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,正确;故选CD;
33.①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,而放出的热量Q>0;
②平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=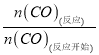 ×100%=
×100%=![]() ×100%=80%;
×100%=80%;
CO(g)+2H2(g)≒CH3OH(g)单位为mol/L
反应开始(mol/L) 1 3 0
反应(mol/L) 0.8 1.6 0.8
平衡(mol/L) 0.2 1.4 0.8
平衡常数K=![]() =2.04,所以温度是250℃;
=2.04,所以温度是250℃;
34.a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;
b.催化剂对平衡移动无影响,故错误;
c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;
d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;
f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
故选df;
35.因为T1>T2>T3,所以温度越低平衡常数越大,反应物转化率越大,又催化剂同等程度加快反应速率,所以既能在低温下作用又能加快反应速率的催化剂最好选用Z。

 阅读快车系列答案
阅读快车系列答案【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:
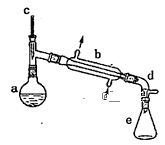
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为__。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
Ⅲ.产物分析及产率计算
(3)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有___种不同化学环境的氢原子。
②本实验所得环己烯的产率是___。
【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
H3PO4(浓)+NaBr![]() NaH2PO4+HBr、CH3CH2OH+HBr
NaH2PO4+HBr、CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
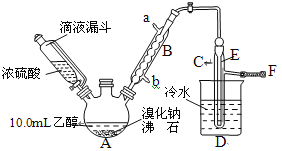
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度g/mL | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是___。
(2)仪器B的名称为___,B中进水口为___(填“a”或“b”)口。
(3)实验中用滴液漏斗代替分液漏斗的优点为:___。
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?___(用化学方程式表示)。
(5)将C中的馏出液转入三角烧瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是___。