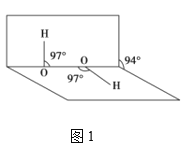
题目内容
【题目】下列实验中,实验操作、装置、现象及结论都正确的是
选项 | 实验操作或装置 | 实验现象 | 相关解释及结论 |
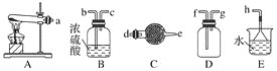
A. | 用两支试管各取5 mL 0.1 mol·L-1酸性KMnO4溶液,分别加入2 mL 0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液 | 两试管溶液均褪色,且加0.2 mol·L-1H2C2O4的试管中褪色更快 | 其他条件不变,H2C2O4浓度越大,化学反应速率越大 |
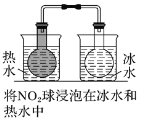
B. |
| 左球气体颜色加深,右球气体颜色变浅 | 勒夏特列原理 |
C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
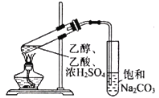
D. |
| 饱和Na2CO3溶液上有透明的不溶于水的油状液体产生 | 乙酸乙酯难溶于水 |
A.AB.BC.CD.D
【答案】B
【解析】
A.草酸和高锰酸钾反应的比为5:2,用两支试管各取5 mL 0.1 mol·L-1酸性KMnO4溶液,分别加入2 mL 0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液,草酸不足,高锰酸钾不褪色,故A错误;
B.2NO2![]() N2O4,正反应放热,升高温度平衡逆向移动,NO2浓度增大,颜色加深,故B正确;
N2O4,正反应放热,升高温度平衡逆向移动,NO2浓度增大,颜色加深,故B正确;
C.氧化铝的熔点高,用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,形成氧化铝膜,熔化后的液态铝不滴落,故C错误;
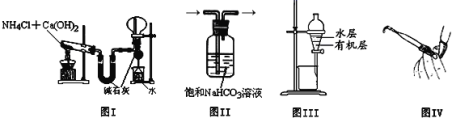
D.制备乙酸乙酯,为防止倒吸,右侧长导管不能伸入饱和碳酸钠溶液中,故D错误;
选B。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目