题目内容
(10分)
⑴.在一定条件下,容积为 100 L密闭容器中发生反应:CH4(g)+H2O(g) 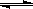 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 l0 min时有0.1 mol CO生成,则10 min内该反应的平均速率v(H2) 。
⑵.在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。

①该反应的△H 0 (填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K= (用含a、V的代数式表示)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
(1) 0.0003 mo1·L -1·min-1
(2) ① <; ② V 2/a2 ③增大;不变
【解析】(1)CH4(g)+H2O(g)
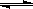 CO(g)+3H2(g)
CO(g)+3H2(g)
起始 1 2
转化 0.1 0.3
所以v(H2)=0.3mol÷100L÷10min=0.0003 mo1·L -1·min-1
(2)①由图可知,随着温度的升高,CO转化率逐渐降低,所以平衡逆向进行,所以反应为放热反应
②
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始 a 2a
转化 0.5 a 1a 0.5 a
平衡 0.5a a 0.5a
K=(0.5a÷V)÷(a/v)2×(0.5a÷V)= V 2/a2
③利用等效平衡原理,体积不变,则平衡正向移动,CO转化率增大,但因为温度没变平衡常数不变。

 反应 X(g)+Y(g)?2Z(g)(正反应为放热反应),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图曲线a所示,欲使该关系如曲线b所示,可采取的措施是( )
反应 X(g)+Y(g)?2Z(g)(正反应为放热反应),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图曲线a所示,欲使该关系如曲线b所示,可采取的措施是( )