题目内容
在一密闭,恒容的容器内进行下列反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),在一定条件下建立平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是( )
分析:向反应容器中通入少量的氯化氢气体,与氨气结合合成氯化铵,反应物浓度减小,平衡逆向移动,以此来解答.
解答:解:向平衡状态投入HCl,HCl与NH3相遇立即生成NH4Cl(S)使NH3浓度变小,平衡左移,
A.平衡逆向移动,气体的压强减小,故A错误;
B.平衡逆向移动,故B错误;
C.反应物浓度减小,则正反应速率减小,平衡逆向移动,则NO的浓度降低,故C正确;
D.平衡逆向移动,则NO的浓度降低,故D正确;
故选CD.
A.平衡逆向移动,气体的压强减小,故A错误;
B.平衡逆向移动,故B错误;
C.反应物浓度减小,则正反应速率减小,平衡逆向移动,则NO的浓度降低,故C正确;
D.平衡逆向移动,则NO的浓度降低,故D正确;
故选CD.
点评:本题考查化学平衡移动的影响因素,把握浓度对化学平衡的影响即可解答,注意把握氯化氢和氨气的反应导致反应体系中浓度的变化,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是( )
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是( )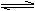 3C(g),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
3C(g),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:  3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是: