题目内容
13.下列对化学知识的认识中错误的是( )| A. | 0.1mol/L的醋酸溶液中c(H+)=0.1mol/L | |
| B. | 0.1mol/L 的NaClO溶液中pH>7 | |
| C. | 任何一个化学变化都伴随着能量的变化 | |
| D. | 新制的氯水中存在着三种分子 |
分析 A.醋酸部分电离;
B.NaClO属于强碱弱酸盐,水解显碱性;
C.化学变化中旧键断裂要吸收能量,新键形成要放出能量;
D.新制的氯水中有HClO、水分子和氯气分子.
解答 解:A.醋酸是弱酸,在溶液中部分电离,所以0.1mol/L的醋酸溶液中c(H+)<0.1mol/L,故A错误;
B.NaClO属于强碱弱酸盐,水解显碱性,所以0.1mol/L 的NaClO溶液中pH>7,故B正确;
C.化学变化中旧键断裂要吸收能量,新键形成要放出能量,所以任何一个化学变化都伴随着能量的变化,故C正确;
D.新制的氯水中有HClO、水分子和氯气分子,即新制的氯水中存在着三种分子,故D正确.
故选A.
点评 本题考查了弱电解质的电离、盐的水解、化学反应中的能量变化、氯水的成分等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
Ⅱ.测定中和热的实验装置如图所示
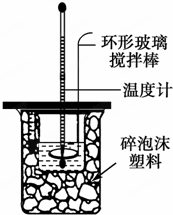
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5 kJ/mol(取小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
18. 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | W的氢化物比X的氢化物的稳定性高 | |
| C. | Y元素比W元素的非金属性强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
5.下列关于高分子化合物的叙述正确的是( )
| A. | 高分子化合物结构复杂,相对分子质量很大 | |
| B. | 对于一块高分子材料来说,n是一个整数,因而它的相对分子质量是确定的 | |
| C. | 高分子化合物是纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料 |
2.燃料电池是一类应用广泛的原电池.乙醇碱性燃料电池便是一种典型的代表.该电池负极
的电极反应为( )
的电极反应为( )
| A. | C2H5OH-12e-+12OH-═2CO2+9H2O | B. | O2+4H++4e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | C2H5OH+16OH--12e-═2CO32-+11H2O |

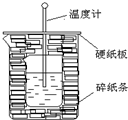 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: