题目内容
18. 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | W的氢化物比X的氢化物的稳定性高 | |
| C. | Y元素比W元素的非金属性强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
分析 根据元素周期表知,X、Y、Z、W、B分别是N、S、Br、P、Ar元素,
A.常压下,常温下Y的单质为固体,而Z的单质为液体;
B.元素的非金属性越强其氢化物的稳定性越强;
C.同一周期元素,元素的非金属性随着原子序数增大而增强;
D.Y、Z的简单阴离子分别含有18、36个电子,B原子核外有18个电子.
解答 解:根据元素周期表知,X、Y、Z、W、B分别是N、S、Br、P、Ar元素,
A.常温下Y的单质为固体,而Z的单质为液体,则常压下五种元素的单质中Y单质的沸点最高,故A错误;
B.非金属性X>W,则氢化物的稳定性X>W,故B错误;
C.同一周期元素,元素的非金属性随着原子序数增大而增强,所以非金属性Y>W,故C正确;
D.Y、Z的简单阴离子分别含有18、36个电子,B原子核外有18个电子,所以Y阴离子的电子层结构与B原子的相同,故D错误;
故选C.
点评 本题考查位置、结构、性质的关系及应用,注意利用元素的位置推断出元素是解答的关键,熟悉非金属性比较的方法及单质的性质即可解答,题目难度不大.

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
9.下列说法正确的是( )
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
6.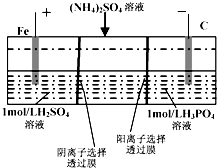 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
13.下列对化学知识的认识中错误的是( )
| A. | 0.1mol/L的醋酸溶液中c(H+)=0.1mol/L | |
| B. | 0.1mol/L 的NaClO溶液中pH>7 | |
| C. | 任何一个化学变化都伴随着能量的变化 | |
| D. | 新制的氯水中存在着三种分子 |
3.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 常温下,1mol Cu与足量的该硫酸反应产生2g氢气 | |
| C. | 等质量的水与该硫酸混合所得溶液的物质的量浓度小于9.2mol/L | |
| D. | 配制240mL 4.6mol/L的稀硫酸需取该硫酸60mL |
10.下列表示物质结构的化学用语或模型图正确的是( )
| A. | H2O2的电子式: | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |
7.下列有关物质性质和应用都正确的是( )
| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 明矾净水是因为Al(OH)3胶体能消毒 | |
| C. | MgO、Al2O3熔点高,它们都可用于制作耐火材料 | |
| D. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
8.下列说法正确的是( )
| A. | 原子最外层电子数大于3的元素一定是非金属元素 | |
| B. | 碱金属单质的密度随原子序数的增大而依次增大 | |
| C. | 一个氕原子实际上就是一个质子 | |
| D. | 某元素形成的离子为${\;}_{a}^{b}$Xn-,则1个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$g |
