题目内容
【题目】25℃时,向20mL 0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是

A. a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/L
B. b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)
C. 对应溶液的导电性:b > c
D. a、b、c、d中,d点所示溶液中水的电离程度最大
【答案】D
【解析】A、a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)= ![]() mol·L-1,故A错误;B、b点所示溶液相当于Na2R,R2― 部分水解生成HR― ,HR― 再水解生成H2R,故c (Na+) >c(R2-)>c(HR-)> c (H2R),B错误;C、溶液的导电性强弱与溶液中阴阳离子的浓度大小和离子所带的电荷数有关系,c点溶液中离子浓度大,对应溶液的导电性:b < c,故C错误;D、a、b抑制水电离,c点PH=7,不影响水电离,d点促进水电离,故D正确;故选D。
mol·L-1,故A错误;B、b点所示溶液相当于Na2R,R2― 部分水解生成HR― ,HR― 再水解生成H2R,故c (Na+) >c(R2-)>c(HR-)> c (H2R),B错误;C、溶液的导电性强弱与溶液中阴阳离子的浓度大小和离子所带的电荷数有关系,c点溶液中离子浓度大,对应溶液的导电性:b < c,故C错误;D、a、b抑制水电离,c点PH=7,不影响水电离,d点促进水电离,故D正确;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
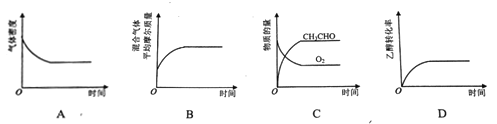
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5, ![]() ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
【题目】I.为了探究化学反应速率及其影响因素,某研究小组以盐酸和碳酸钙反应进行了如下实验。实验方案与数据如下表,t表示收集a mLCO2所需的时间。
序号 | 反应温度/℃ | C(HCl)/ mol·L-1 | V(HCl)/ mL | 10g碳酸钙的形状 | t/min |
1 | 20 | 2 | 10 | 块状 | t1 |
2 | 20 | 2 | 10 | 粉末 | t2 |
3 | 20 | 4 | 10 | 粉末 | t3 |
4 | 40 | 2 | 10 | 粉末 | t4 |
(1)设计实验1和实验2的目的是研究 _________________对化学反应速率的影响。
(2)为研究温度对对化学反应速率的影响,可以将实验_____和实验____(填序号)作对比。
(3)将实验2和实验3作对比,可知t2___________t3(填“﹥”、“﹤”或“﹦”)。
II.在一体积为10L密闭容器中,通入一定量的CO和H2O,在 850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g),CO浓度变化如图,
CO2(g)+H2(g),CO浓度变化如图,

(1)则0~4 min的平均反应速率v(CO)=_____________mol·L-1·min -1。
(2)该反应达到最大限度所需的时间为____________,此时CO的转化率为_____________。
【题目】将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是( )
选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液 | 变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有漂白性 |
C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有酸性、漂白性 |
D | KI淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
A. A B. B C. C D. D
【题目】二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) H1
CH3OCH3(g)+H2O(g) H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g) H2=-90.7 kJ·mol-1
CH3OH(g) H2=-90.7 kJ·mol-1
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H3
CH3OCH3(g)+H2O(g) H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如下:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
则H1=__________kJ·mol-1、H3=__________kJ·mol-1
(2)反应①的化学平衡常数表达式为_____________。
制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______________。

下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=_____________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因___________。