题目内容
在容积为1L的密闭容器中,进行如下反应:
A(g)+2B(g)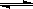 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:

(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
A(g)+2B(g)
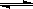 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)0.24mol·L—1·min—1
(2)AB(2分,漏一个扣1分,错选不得分)
(3)0.9(mol·L—1)—1(单位可不写)吸热
(4)向正反应方向
(2)AB(2分,漏一个扣1分,错选不得分)
(3)0.9(mol·L—1)—1(单位可不写)吸热
(4)向正反应方向
(1)800℃时。0—5min内,生成D是0.6mol,则消耗B是1.2mol,所以B的反应速率是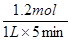 =0.24mol·L—1·min—1。
=0.24mol·L—1·min—1。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以B正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系D不正确;反应过程中压强是变化的,所以当压强不再发生变化时,可以说明,A正确;C中反应速率的方向相反,但不能满足相应的化学计量数之比,所以不正确,答案选AB。
(3)平衡时A、B、C、D的浓度分别是(mol/L)0.4、1.0、0.6、0.6,所以反应的平衡常数是 ;根据图像可知,升高温度,D的含量增加,说明正反应一定是吸热反应。
;根据图像可知,升高温度,D的含量增加,说明正反应一定是吸热反应。
(4)在700℃平衡时A、B、C、D的浓度分别是(mol/L)0.55、1.3、0.45、0.45,所以反应的平衡常数是 ;由于此时
;由于此时 <0.22,所以向正反应方向进行。
<0.22,所以向正反应方向进行。
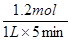 =0.24mol·L—1·min—1。
=0.24mol·L—1·min—1。(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以B正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系D不正确;反应过程中压强是变化的,所以当压强不再发生变化时,可以说明,A正确;C中反应速率的方向相反,但不能满足相应的化学计量数之比,所以不正确,答案选AB。
(3)平衡时A、B、C、D的浓度分别是(mol/L)0.4、1.0、0.6、0.6,所以反应的平衡常数是
 ;根据图像可知,升高温度,D的含量增加,说明正反应一定是吸热反应。
;根据图像可知,升高温度,D的含量增加,说明正反应一定是吸热反应。(4)在700℃平衡时A、B、C、D的浓度分别是(mol/L)0.55、1.3、0.45、0.45,所以反应的平衡常数是
 ;由于此时
;由于此时 <0.22,所以向正反应方向进行。
<0.22,所以向正反应方向进行。
练习册系列答案
相关题目
 2NH3(g);△H<0
2NH3(g);△H<0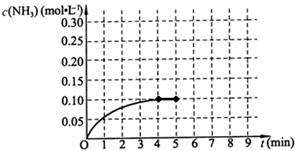
 ?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小
?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小 ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大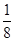 ,则方程式中a值是
,则方程式中a值是 PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )
PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( ) xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白: (6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。 2E(g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,则达平衡时M的转化率为
2E(g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,则达平衡时M的转化率为 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g) 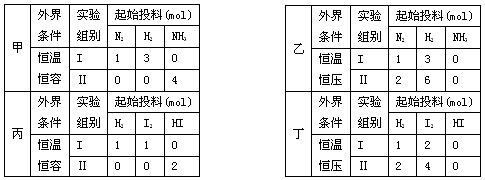
 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )