题目内容
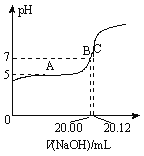
【题目】某温度下,向一定体积0.1 mol·L-1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示。

下列说法正确的是( )
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【答案】C
【解析】
试题分析:A、醋酸是弱酸,加入NaOH后反应生成CH3COONa,CH3COONa是强电解质,M点溶质是CH3COOH和CH3COONa,CH3COOH量较多,导电能力最弱,故错误;B、N点溶液显碱性,根据电荷守恒,应是c(Na+)>c(CH3COO-),故错误;C、M点的H+浓度等于N点OH-浓度,对水的电离抑制能力相同,故正确;D、Q点溶液显中性,消耗的NaOH的体积略小于醋酸溶液的体积,故错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25℃时反应Ni(CO)4(g)![]() Ni(s) + 4CO(g)的平衡常数为0.5
Ni(s) + 4CO(g)的平衡常数为0.5
C. 在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol·L-1,则此时温度高于80℃
D. 80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小