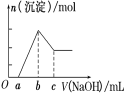
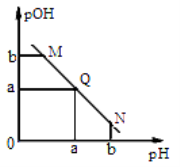
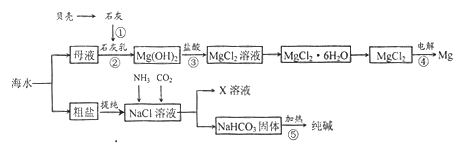
��Ŀ����
����Ŀ����300mL���ܱ������У��������۲�����һ������CO���壬һ�������·�����Ӧ��Ni(s) + 4CO(g)![]() Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ���±���
Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ���±���
����˵����ȷ���ǣ� ��
�¶�/�� | 25 | 80 | 230 |
ƽ�ⳣ�� | 5��104 | 2 | 1.9��10��5 |
A. ��������Ni(CO)4(g)�ķ�ӦΪ���ȷ�Ӧ
B. 25��ʱ��ӦNi(CO)4(g)![]() Ni(s) + 4CO(g)��ƽ�ⳣ��Ϊ0.5
Ni(s) + 4CO(g)��ƽ�ⳣ��Ϊ0.5
C. ��ij�����´ﵽƽ�⣬���Ni(CO)4��COŨ�Ⱦ�Ϊ0.5mol��L��1�����ʱ�¶ȸ���80��
D. 80��ﵽƽ��ʱ������������䣬����ϵ�г���һ������CO���ٴδﵽƽ���CO�����������С
���𰸡�D
�����������������A����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ����С���������Ӧ�����Ƿ��ȷ�Ӧ���ʴ���B��Ni(s)��4CO(g)![]() Ni(CO)4(g)����ѧƽ�ⳣ���ı���ʽΪK1=c[Ni(CO)4]/c4(CO)��Ni(CO)4(g)
Ni(CO)4(g)����ѧƽ�ⳣ���ı���ʽΪK1=c[Ni(CO)4]/c4(CO)��Ni(CO)4(g)![]() Ni(s)��4CO(g)����ѧƽ�ⳣ���ı���ʽΪK2=c4(CO)/c[Ni(CO)4] ��K2=1��K��11=1/(5��104)=2��10��5���ʴ���C����ѧƽ�ⳣ��Ϊ0.5/0.54=8������¶�С��80�����ʴ���D���൱������ѹǿ��ƽ��������Ӧ������У��ﵽƽ��CO�����������С������ȷ��
Ni(s)��4CO(g)����ѧƽ�ⳣ���ı���ʽΪK2=c4(CO)/c[Ni(CO)4] ��K2=1��K��11=1/(5��104)=2��10��5���ʴ���C����ѧƽ�ⳣ��Ϊ0.5/0.54=8������¶�С��80�����ʴ���D���൱������ѹǿ��ƽ��������Ӧ������У��ﵽƽ��CO�����������С������ȷ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�