题目内容
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”)。
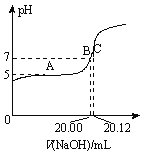
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
【答案】.
Ⅰ.(1)>;(2)2×10-5;0.1006 mol/L
Ⅱ.(1)BD;(2)0.125 mol/(L·min) ;(3)81 ;(4)>;(5)不变
【解析】
试题分析:Ⅰ.(1)相同温度下,酸的浓度越小其电离程度越大,所以pH=3醋酸的浓度大于pH=4醋酸浓度的10倍,100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,前者的物质的量大于后者,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;故答案为:>;
(2)根据C中物料守恒得醋酸浓度=![]() =0.1006mol/L,A为缓冲溶液,pH=pKa-lgc(CH3COO-)/lgc(CH3COOH),5=pKa-lg2,10-5=
=0.1006mol/L,A为缓冲溶液,pH=pKa-lgc(CH3COO-)/lgc(CH3COOH),5=pKa-lg2,10-5=![]() ,Ka=2×10-5,故答案为:2×10-5;0.1006 mol/L.
,Ka=2×10-5,故答案为:2×10-5;0.1006 mol/L.
Ⅱ.(1)A.无论反应是否达到平衡状态,容器中压强始终不变,所以不能据此判断是否达到平衡状态,故错误;B.当混合气体密度不变时,该反应达到平衡状态,故正确;C.无论反应是否达到平衡状态,都存在1mol H-H键断裂同时形成2mol H-O,所以不能据此判断是否达到平衡状态,故错误;D.H2的体积分数不变时,该反应达到平衡状态,故正确;故选BD;
(2)第2min时,气体质量增加8g,则参加反应的氢气的物质的量=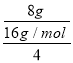 ×4=0.5mol,氢气的平均反应速率=
×4=0.5mol,氢气的平均反应速率=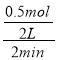 =0.125mol/(L·min),故答案为:0.125mol/(L·min);
=0.125mol/(L·min),故答案为:0.125mol/(L·min);
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,设氢气的物质的量为xmol、水蒸气的物质的量为ymol,则其平均摩尔质量=![]() =14g/mol,x:y=1:3,同一容器其浓度之比为1:3,则该温度下的平衡常数K=(
=14g/mol,x:y=1:3,同一容器其浓度之比为1:3,则该温度下的平衡常数K=(![]() )4=81,故答案为:81;
)4=81,故答案为:81;
(4)若降低温度,K值减小,说明平衡向逆反应方向移动,则正反应是吸热反应,则反应的△H>0,故答案为:>;
(5)若反应达平衡后,加入少量的H2,平衡向正反应方向移动,但反应前后压强不变,所以再次平衡后,H2O的体积分数不变,故答案为:不变。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案