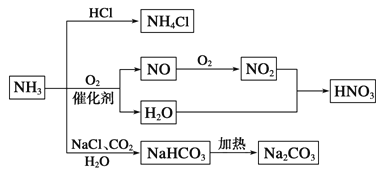
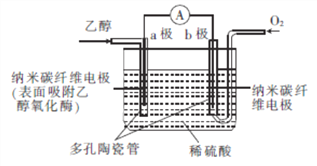
题目内容
【题目】将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是
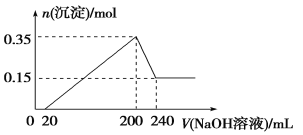
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的稀硫酸
C.氢氧化钠溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
【答案】D
【解析】
试题分析:从图象中看到,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2so4+2NaOH=Na2so4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;
A、当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2 ,n(Mg)=n[Mg(OH)2 ]=0.15mol,
m(Mg)=0.15mol×24gmol-1=3.6g,n(Al)=n[Al(OH)3 ]=0.35mol-0.15mol=0.2mol,m(Al)=0.2mol×27gmol-1=5.4g,所以镁和铝的总质量为9g,A项正确,B项正确。C.从200mL到240mL,NaOH溶解Al(OH)3 :NaOH+Al(OH)3 =NaAlO2 +2H2O,则此过程消耗n(NaOH)=n[Al(OH)3 ]=0.2mol,c(NaOH)=0.2mol÷0.04 L=5molL-1,C项正确;D、由Mg+H2so4=Mgso4+H2↑,2Al+3H2so4=2Al2(so4)3+3H2↑可以计算出生成n(H2)=0.45mol,标准状况下V(H2)=0.45mol×22.4Lmol-1=10.08L,D项错误。答案选D。

【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)100 mL溶液中c(SO42-)=________________。
(2)第二份加入NaOH溶液产生气体的离子方程式___________________________。
(3)6.27 g沉淀的成分是______________ (用化学式表示)。
(4)上述澄清溶液中除SO42-以外,一定大量存在的离子是__________________。