题目内容
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)100 mL溶液中c(SO42-)=________________。
(2)第二份加入NaOH溶液产生气体的离子方程式___________________________。
(3)6.27 g沉淀的成分是______________ (用化学式表示)。
(4)上述澄清溶液中除SO42-以外,一定大量存在的离子是__________________。
【答案】 0.1 mol·L-1 NH4++OH- ![]() NH3↑+H2O BaSO4、BaCO3 CO32-、K+、NH4+
NH3↑+H2O BaSO4、BaCO3 CO32-、K+、NH4+
【解析】根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4沉淀,因此两者不能大量共存.Ba2+和CO32-可发生离子反应生成BaCO3沉淀,因此两者也不能大量共存
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+(Mg2+可以和OH-反应生产氢氧化镁沉淀).故可确定一定含有NH4+,一定不存在Mg2+
根据反应NH4++OH—![]() NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+.
由条件可知BaSO4为2.33g,物质的量为2.33/233=0.01mol,BaCO3为6.27g-2.33g═3.94g,物质的量为3.94/197=0.02mol,则CO32-物质的量为0.02mol
由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须含有Cl—

【题目】无机化合物可根据其组成和性质进行分类
(1)下图所示的物质分类方法名称是________。
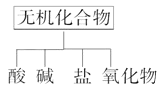
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学 式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O |
(3)写出⑦转化为⑤的化学方程式______________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是________________。
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g) ===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g) ===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:__________________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_____________________________。

②已知CO中的C与O之间为三键,其键能为x kJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42 - |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。

(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2,O2穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。