题目内容
19.下列物质经催化加氢后能得到 的是( )
的是( )| A. | CH3CH=CHCHCH2CH3 | B. | CH2=CHCHCH2CH3 | ||
| C. | CH≡CCHCH2CH3 | D. |  |
分析 根据加成原理,不饱和键断开,结合H原子,生成 ,采取倒推法相邻碳原子之间各去掉氢原子形成不饱和键,即得到不饱和烃.
,采取倒推法相邻碳原子之间各去掉氢原子形成不饱和键,即得到不饱和烃.
解答 解:2-甲基戊烷的碳链结构为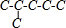 ,2-甲基戊烷相邻碳原子之间各去掉1个氢原子形成双键,从而得到烯烃;根据2-甲基戊烷的碳链结构知,相邻碳原子上各去掉1个氢原子形成双键的碳链结构有:
,2-甲基戊烷相邻碳原子之间各去掉1个氢原子形成双键,从而得到烯烃;根据2-甲基戊烷的碳链结构知,相邻碳原子上各去掉1个氢原子形成双键的碳链结构有: 、
、 、
、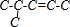 、
、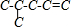 ,若为三键可以是
,若为三键可以是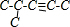 、
、 ,
,
故选D.
点评 本题考查根据烷烃判断相应的不饱和烃,难度较大,会根据烷烃结构去掉相邻氢原子形成不饱和键,注意不能重写、漏写.也可以根据加成原理写出选项中与氢气加成的产物,进行判断.

练习册系列答案
相关题目
9.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下:
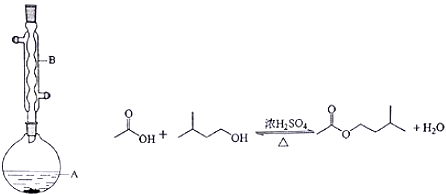
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的作用是冷凝回流
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸;第二次水洗的主要目的是:洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高异戊醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯
(6)在蒸馏操作中,仪器选择及安装都正确的是:b(填标号)

(7)本实验的产率是60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙 酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的作用是冷凝回流
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸;第二次水洗的主要目的是:洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高异戊醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯
(6)在蒸馏操作中,仪器选择及安装都正确的是:b(填标号)

(7)本实验的产率是60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量未反应的异戊醇.
10.下列关于钠的叙述正确的是( )
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
7.某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
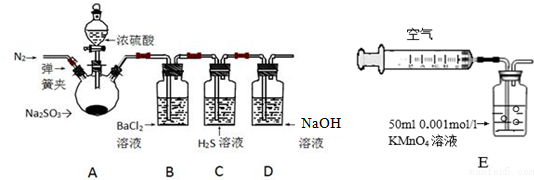
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化 性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)$\frac{2.8}{V}$.

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化 性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管中,滴入几滴酚酞 | 溶液变红 |
| 2 |
4.关于炔烃的描述中正确的是( )
| A. | 分子组成符合CnH2n-2通式的链烃一定是炔烃 | |
| B. | 炔烃既易发生加成反应,又易发生取代反应 | |
| C. | 炔烃既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 炔烃分子里所有的碳原子都在同一条直线上 |
11.X、Y、Z三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放250mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加6.4g.常温下各烧杯中溶液的pH与电解时间t的关系图2如下.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”).电解一段时间后,在e、f两极附近分别滴加酚酞,变红的是e极.
(2)甲烧杯中电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(3)乙烧杯电解的总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;甲烧杯中a、b两极共产生标准状况下3.36L的气体.
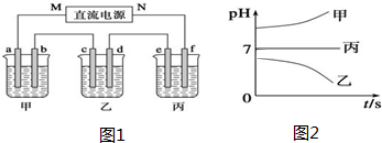
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放250mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加6.4g.常温下各烧杯中溶液的pH与电解时间t的关系图2如下.据此回答下列问题:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
(2)甲烧杯中电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(3)乙烧杯电解的总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;甲烧杯中a、b两极共产生标准状况下3.36L的气体.

8.在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
| A. | 一定有I- | B. | 可能含Fe3+ | C. | 可能有Cl- | D. | 不含NO3- |
9.在1.00L 1mol/L氢氧化钠溶液中通入16.8L标准状况下的CO2气体,所得的溶液中含有的溶质是( )
| A. | Na2CO3 | B. | NaHCO3 | ||
| C. | Na2CO3和NaHCO3 | D. | NaOH、Na2CO3和NaHCO3 |
 天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.