题目内容
【题目】某溶液中含有大量的H+、Ba2+、Ag+,该溶液中还可能大量共存的是
A. SO42-B. Cl-C. CO32-D. NO3-
【答案】D
【解析】
A.SO42-与Ba2+、Ag+会形成BaSO4、Ag2SO4沉淀,不能大量共存,A错误;
B. Cl-与Ag+会发生反应,形成AgCl白色沉淀,不能大量共存,B错误;
C.CO32-与Ba2+、Ag+会形成BaCO3、Ag2CO3沉淀,不能大量共存,C错误;
D.NO3-与选项中的离子不能发生任何反应,可以大量共存,D正确;
故合理选项是D。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
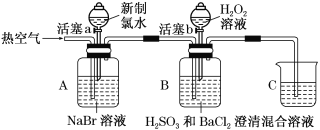
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加少量新制氯水,关闭活塞a | A中溶液变为浅红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | B中开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)实验操作Ⅰ时,A中反应的离子方程式为__________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________________。
(3)装置C的作用是______________________;C中盛放的药品是________。
(4)实验操作Ⅲ中混合液逐渐变成红棕色,其对应的离子方程式为_____________。
(5)由上述实验得出的结论是______________________________________。
(6)①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否有干扰,理由是_______________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是________________(写出一条即可)。
【题目】通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质)与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅)

相关信息如下:a.四氧化硅遇水极易反应生成硅酸和氯化氢;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出用碳在高温下还原二氧化硅制得粗硅的化学方程式_________________________。
(2)写出装置A中发生反应的离子方程式__________________________________。
(3)装置A中g管的作用是_________________;装置C中的试剂是____________;
(4)装置E中h瓶收集到的粗产物可通过多次蒸馏得到高纯度四氯化硅,蒸馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(5)写出尾气处理装置中发生反应的离子方程式___________________________。
(6)本题实验装置中有一明显的不足之处,请简述你的改进方案及理由: ___________。

