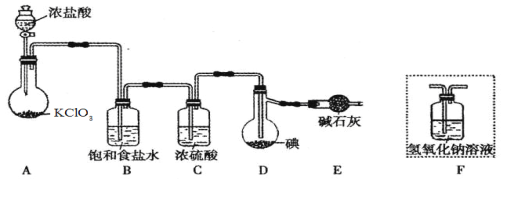
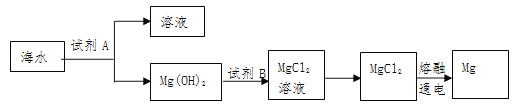
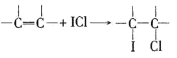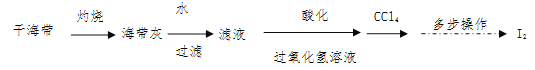题目内容
【题目】为探索工业含铝、铁、铜合金废料的再利用,化学科技小组的同学们进行了一系列实验探究。他们设计的实验方案如图,其中Y气体是空气的主要成分之一。

请回答下列问题:
(1)操作①用到的玻璃仪器有烧杯、 。
(2)气体X的分子式为 。
(3)反应④的化学反应方程式为 。
(4)常温下,将绿矾配成约0.1molL-1FeSO4溶液,测得溶液的pH=3。请用离子方程式解释原因 ,该溶液中c(SO42-)-c(Fe2+)= molL-1(填数值)。
(5)若要测定所配溶液中Fe2+的准确浓度,取20.00mL溶液于锥形瓶中,可再直接用酸性KMnO4标准溶液进行滴定,滴定终点的现象是 。
【答案】(1)漏斗、玻璃棒;(2)CO2;(3)2Cu+2H2SO4+O2=2CuSO4+2H2O;(4)Fe2++2H2OFe(OH)2+2H+;5×10-4;(5)滴入最后一滴酸性KMnO4溶液,溶液变为浅紫色(或浅紫红色),且30s内无变化。
【解析】
试题分析:(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒、普通漏斗;(2)滤液A为NaAlO2,因为氢氧化铝是两性,不溶于碳酸,因此通入的是过量CO2;(3)滤渣B是铜和铁,反应③中加入H2SO4,滤渣E为铜,Y是O2,反应方程式为:2Cu+2H2SO4+O2=2CuSO4+2H2O;(4)FeSO4属于强酸弱碱盐,Fe2+水解,其水解方程式为Fe2++2H2OFe(OH)2+2H+;根据溶液显电中性,c(H+)+2c(Fe2+)=2c(SO42-)+c(OH-)c(SO42-)-c(Fe2+)=[c(H+)-c(OH-)]/2=(10-3-10-11)/2mol·L-1=5×10-4mol·L-1;(5)利用高锰酸钾的氧化性,滴入最后一滴酸性KMnO4溶液,溶液变为浅紫色(或浅紫红色),且30s内无变化。