题目内容
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:
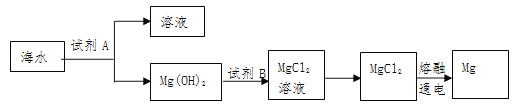
①Mg(OH)2转化为MgCl2的离子方程式是 ,
②将MgCl2溶液在 气流中 、蒸发、冷却、结晶制得MgCl2晶体。
③由无水MgCl2制取Mg的化学方程式是________________________。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
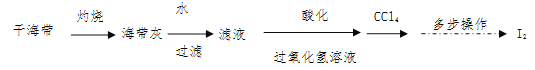
①灼烧海带至灰烬时所用的主要仪器名称是________________。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式: 。
③反应结束后,可加入 作萃取剂,采用萃取-分液的方法从碘水中提取碘。
【答案】(1)①Mg(OH)2 + 2H+=Mg2+ + 2H2O, ②氯化氢,加热。③MgCl2 ![]() Mg + Cl2↑。
Mg + Cl2↑。
(2)①坩埚。②2H++2I-+H2O2![]() I2+2H2O。③CCl4或苯。
I2+2H2O。③CCl4或苯。
【解析】
试题分析:(1)①Mg(OH)2与盐酸反应生成MgCl2和水,离子方程式是Mg(OH)2 + 2H+=Mg2+ + 2H2O, ②为防止Mg2+水解,应将MgCl2溶液在氯化氢气流中加热、蒸发、冷却、结晶制得MgCl2晶体。③由无水MgCl2制取Mg的化学方程式是MgCl2 ![]() Mg + Cl2↑。
Mg + Cl2↑。
(2)①固体的灼烧所用的主要仪器名称是坩埚。②酸性条件下,碘离子与过氧化氢溶液反应生成I2和水,该反应的离子方程式为2H++2I-+H2O2![]() I2+2H2O。③碘单质在水中的溶解度不大,易溶于苯、四氯化碳等有机溶剂,故反应结束后,可加入CCl4或苯作萃取剂,采用萃取-分液的方法从碘水中提取碘。
I2+2H2O。③碘单质在水中的溶解度不大,易溶于苯、四氯化碳等有机溶剂,故反应结束后,可加入CCl4或苯作萃取剂,采用萃取-分液的方法从碘水中提取碘。

【题目】下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 | ⅠA | ⅡA | Ⅲ A | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为 。
(4)从⑤到⑧的元素中, 离子半径最小(填离子符号)。
(5)元素③与⑤形成的具有强氧化性的化合物的电子式 。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强