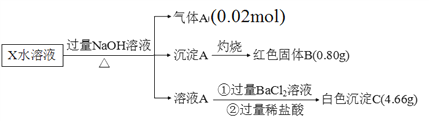
题目内容
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+ 11O2= 4B2O3+ 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
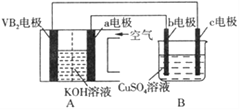
A. VB2电极发生的电极反应为:2VB2+ 11H2O - 22e-= V2O5+ 2B2O3+ 22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,c电极表面先有红色物质析出,b电极有气泡产生
D. 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1mol/L
【答案】C
【解析】A. A装置为原电池,其中a电极得电子为正极,VB2电极为负极,发生的电极反应为:2VB2+ 22OH- - 22e-= V2O5+ 2B2O3+ 11H2O,故A错误;B. 外电路中电子由VB2电极流向c电极,故B错误;C. 电解过程中,c为阴极,发生还原反应,先生成铜,后产生氢气,电极表面先有红色物质析出,后有气泡产生,b电极为阳极,失去电子发生氧化反应,有O2产生,故C正确;D. B装置内共收集到气体为0.448L,即0.02mol,此时外电路通过电子为0.04mol,电解硫酸铜溶液的反应:2CuSO4+2H2O==2Cu+2H2SO4+O2↑经过计算可知,若硫酸铜没有耗尽,生成的气体仅为O2,则当外电路通过0.04mol电子时,生成氧气为0.01mol,因此此时硫酸铜已经耗尽,反应开始电解水。当外电路通过0.04mol电子时,生成氧气为0.01mol,因此电解水生成氧气为0.005mol,电解硫酸铜溶液生成氧气为0.005mol,所以硫酸铜的物质的量为0.01mol,硫酸铜的物质的量为![]() =0.05mol/L,故D错误;综合以上分析,本题正确答案为C。
=0.05mol/L,故D错误;综合以上分析,本题正确答案为C。