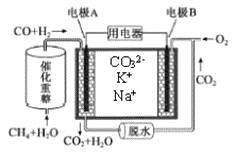
题目内容
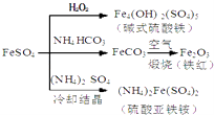
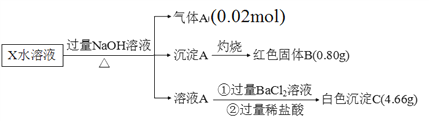
【题目】某无机盐除结晶水外,还含两种阳离子和一种阴离子,摩尔质量为392 g·mol1,为探究其组成和性质,设计并完成了如下实验:
请回答:
(1)X的化学式为_______________。
(2)生成红褐色沉淀A的反应方程式____________________________________________。
(3)检验X溶液中金属阳离子的方法为_______________________________。
【答案】 (NH4)2Fe(SO4)26H2O Fe2+ + 2OH- = Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 先加KSCN溶液无明显现象,再加氯水,溶液变为红色或 滴加酸性KMnO4溶液,溶液褪色
【解析】X的水溶液中加入过量的NaOH溶液,加热,生成0.02mol气体A,气体A为氨气,说明含有0.02mol NH4+,沉淀A灼烧生成红色固体B,B为氧化铁(Fe2O3),含有铁元素的物质的量为![]() ×2=0.01mol,溶液A中加入氯化钡和稀盐酸,生成白色沉淀C,C为硫酸钡,说明含有SO42-,且物质的量=
×2=0.01mol,溶液A中加入氯化钡和稀盐酸,生成白色沉淀C,C为硫酸钡,说明含有SO42-,且物质的量= ![]() =0.02mol,根据电荷守恒,含有的铁元素为Fe2+,化学式为(NH4)2Fe(SO4)2nH2O,根据摩尔质量为392 g·mol1,n=6。
=0.02mol,根据电荷守恒,含有的铁元素为Fe2+,化学式为(NH4)2Fe(SO4)2nH2O,根据摩尔质量为392 g·mol1,n=6。
(1)根据上述分析,X的化学式为(NH4)2Fe(SO4)26H2O,故答案为:(NH4)2Fe(SO4)26H2O;
(2)亚铁离子首先生成氢氧化亚铁,然后氢氧化亚铁被氧化生成氢氧化铁,反应的方程式为Fe2+ + 2OH- = Fe(OH)2↓、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,故答案为:Fe2+ + 2OH- = Fe(OH)2↓、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;
(3)检验Fe2+的方法为:先加KSCN溶液无明显现象,再加氯水,溶液变为红色(或滴加酸性KMnO4溶液,溶液褪色),故答案为:先加KSCN溶液无明显现象,再加氯水,溶液变为红色(或滴加酸性KMnO4溶液,溶液褪色)。