题目内容
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_____________________。
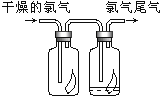
(2)为防止氯气尾气污染空气,实验室通常用______溶液吸收多余的氯气,原理是__________________。
(用化学方程式表示)。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(填字母,下同)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,最适宜采用的该物质是_____________。
A.NaOH B.NaCl C.KCl D.Na2CO3
【答案】 干燥有色布条无明显变化,湿润有色布条颜色褪去 浓NaOH Cl2+2NaOH=NaCl+NaClO+H2O Ca(ClO)2 C D
【解析】试题分析:本题考查氯气的性质,氯气的漂白原理,氯气的尾气吸收,漂白粉的成分和变质。
(1)氯气没有漂白性;氯气的漂白原理是:氯气与水反应生成盐酸和次氯酸,次氯酸具有强氧化性,将有色物质漂白,所以氯气通过干燥有色布条无明显变化,通过湿润有色布条颜色褪去。
(2)为防止氯气尾气污染空气,实验室通常用浓NaOH溶液吸收多余的氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。石灰乳吸收氯气制漂白粉的反应原理为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分为Ca(ClO)2。长期露置于空气中的漂白粉会发生反应:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑,漂白粉变质失效,加入盐酸后发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,则加入盐酸后产生的气体是CO2,答案选C。
2HCl+O2↑,漂白粉变质失效,加入盐酸后发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,则加入盐酸后产生的气体是CO2,答案选C。
(3)A项,NaOH虽然能吸收Cl2,但NaOH具有强腐蚀性,不宜采用;B项,NaCl不能吸收Cl2,不宜采用;C项,KCl 不能吸收Cl2,不宜采用;D项,Na2CO3能吸收Cl2,且没有强腐蚀性,适宜采用;答案选D。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ |
(1)⑤元素的原子结构示意图为_____________;
(2)③元素原子的最外层电子数为___________;
(3)⑤元素与④元素形成的离子化合物的化学式为_________(写出一种即可);
(4)②、③、④三种元素的非金属性逐渐___________(填“减弱”或“增强”);
(5)④元素和⑥元素形成的氢化物,其稳定性的强弱顺序为_______>_______(填化学式)。
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大