题目内容
【题目】某氮肥厂氨氮废水中的氮元素多以NH4+和NH3![]() H2O的形式存在,该废水的处理流程如下:
H2O的形式存在,该废水的处理流程如下:
![]()
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:____________。
②用化学平衡原理解释通空气的目的:__________。
(2) 过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
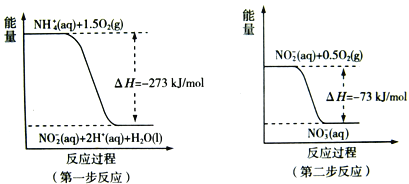
①第一步反应是_________反应(选题“放热”或“吸热”),判断依据是__________。
②1mol NH4+(aq)全部氧化成![]() 的热化学方程式是______________。
的热化学方程式是______________。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗![]() 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
【答案】![]()
![]()
![]() 废水中的NH3被空气带走,使
废水中的NH3被空气带走,使![]() D的平衡向正反应方向移动,利于除氨 放热
D的平衡向正反应方向移动,利于除氨 放热 ![]() H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)
H=-273kJ/mol<0(反应为的总能量大于生成物的总能量) ![]()
![]()
![]()
![]() H=-346kJ/mol 5:6
H=-346kJ/mol 5:6
【解析】
(1)①铵根能和强碱反应生成一水合氨;②减少生成物,可以使化学平衡向正反应方向移动;
(2)①当反应物的总能量大于生成物的总能量,反应是放热的;
②结合图象根据盖斯定律来计算反应的焓变;
(3)根据得失电子守恒来解题。
(1)①铵盐能和强碱反应,实质是:NH4++OH-═NH3![]() H2O,故答案为:NH4++OH-═NH3
H2O,故答案为:NH4++OH-═NH3![]() H2O;
H2O;
②氨水电离是可逆反应,将生成的氨气带走,即减少生成物,可以使化学平衡向正反应方向移动,即更多的生成氨气,因而促进了氨水电离,故答案为:空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离;
(2)①焓变小于0,则反应为放热反应,故答案为:放热;因为![]() H=-273kJ/mol<0(反应物的总能量大于生成物的总能量);
H=-273kJ/mol<0(反应物的总能量大于生成物的总能量);
②第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),![]() H=-273kJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),
H=-273kJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),![]() H=-73kJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),
H=-73kJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),![]() H=-346 kJ/mol,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),
H=-346 kJ/mol,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),![]() H=-346 kJ/mol;
H=-346 kJ/mol;
(3)32gCH3OH(相当于1mol甲醇)作还原剂,失去6mol电子,这样得到6mol电子需要1.2mol硝酸做氧化剂(注:1mol硝酸变成N2需要得到5mol电子),因此参加反应的还原剂和氧化剂的物质的量之比是5:6。故答案为:5:6。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案