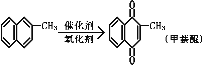
题目内容
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
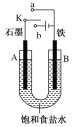
(1)若开始时开关K与a连接,则B极的Fe发生___腐蚀(填“析氢”或“吸氧”),B极的电极反应式为___。
(2)若开始时开关K与b连接,下列说法正确的是___(填序号);
a.溶液中Na+向A极移动
b.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c.反应一段时间后加入适量稀盐酸可使电解质溶液恢复到电解前的浓度
d.若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
此时装置内总反应的离子方程式为___。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
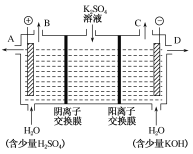
①该电解槽的阳极反应式为___,此时通过阴离子交换膜的离子数___(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口___(填“A”“B”“C”或“D”)导出。
【答案】吸氧 Fe-2e=Fe2+ b 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 2H2O-4e-=O2↑+4H+(或4OH--4e-=2H2O+O2↑) 小于 D
2OH-+H2↑+Cl2↑ 2H2O-4e-=O2↑+4H+(或4OH--4e-=2H2O+O2↑) 小于 D
【解析】
(1)K与a连接,该装置为原电池,发生吸氧腐蚀进行分析;
(2)K与b连接,构成电解池,利用电解原理进行分析;
(3)利用电解原理,以及电解的目的进行分析;
(1)K与a接触,因电解质为氯化钠溶液,则构成有原电池,即吸氧腐蚀,B极为负极,根据原电池工作原理,电极反应式为Fe-2e-=Fe2+;
答案为吸氧;Fe-2e-=Fe2+;
(2)K与b接触,有外加电源,构成装置为电解池,
a. A电极连接电源正极,即A电极为阳极,B电极连接电源的负极,即B电极为阴极,根据电解原理,Na+向B电极移动,故a不符合题意;
b. 根据a的分析,A电极反应式为2Cl--2e-=Cl2↑,Cl2将I-氧化成I2,淀粉变蓝,故b符合题意;
c. 电解饱和食盐水的方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,脱离体系是H2和Cl2,因此恢复到原来状态,需要通入一定量的HCl,而盐酸是HCl的水溶液,故c不符合题意;
2NaOH+H2↑+Cl2↑,脱离体系是H2和Cl2,因此恢复到原来状态,需要通入一定量的HCl,而盐酸是HCl的水溶液,故c不符合题意;
d. B电极反应式为2H2O+2e-=H2↑+2OH-,产生标况下2.24L的气体,转移0.2mol电子,但溶液中移动的阴阳离子,没有电子通过,故d不符合题意;
电解饱和食盐水的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
答案为b;2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(4)①根据装置图,作电极为阳极,其电极反应式为2H2O-2e-=O2↑+4H+,或者4OH--4e-=2H2O+O2↑;为了平衡电荷守恒,SO42-通过阴离子交换膜进入阳极区,右端电极反应式为2H2O+2e-=H2↑+2OH-,为了平衡电荷守恒,K+通过阳离子交换膜进入阴极区,因SO42-所带电荷数大于K+,因此拖过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
答案为2H2O-2e-=O2↑+4H+,或者4OH--4e-=2H2O+O2↑;小于;
②根据①的分析,KOH从出口D导出;
答案为D。