题目内容
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
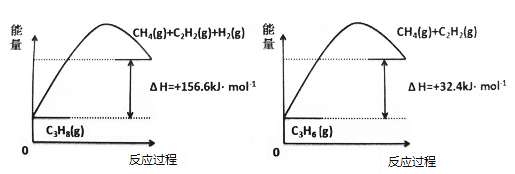
由如图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=__kJ/.mol
C3H6(g)+H2(g),△H=__kJ/.mol
(2)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0。一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
2C3H6(g) △H>0。一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是__。
A.反应速率满足:2v生成(C4H8)=v生成(C3H6)
B.C4H8、C2H4、C3H6的物质的量之比为1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)=__mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=__。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数__![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(3)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
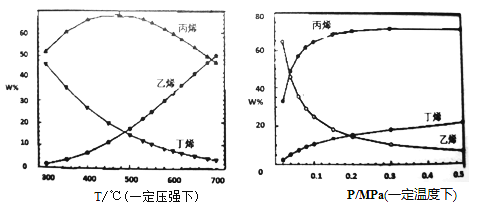
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表的趋势来看,下列反应条件最适宜的是_(填字母序号)。
A.300℃0.1MPa B.700℃0.1MPa C.300℃0.5MPa D.700℃0.5MPa
②图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是__。
【答案】+124.2 ad ![]() 0.5 > c 压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大
0.5 > c 压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大
【解析】
(1)从图中可以提取如下两个热化学方程式:
C3H8(g)![]() CH4(g)+C2H2(g)+H2(g) △H=+156.6kJ/.mol ①
CH4(g)+C2H2(g)+H2(g) △H=+156.6kJ/.mol ①
C3H6(g)![]() CH4(g)+C2H2(g) △H=+32.4kJ/.mol ②
CH4(g)+C2H2(g) △H=+32.4kJ/.mol ②
利用盖斯定律,将①-②得:C3H8(g)![]() C3H6(g)+H2(g),△H=+124.2kJ/.mol。答案为:+124.2;
C3H6(g)+H2(g),△H=+124.2kJ/.mol。答案为:+124.2;
(2)I.A. 2v生成(C4H8)=v生成(C3H6),表示反应进行的方向相反,且速率之比等于化学计量数之比,达到平衡状态;
B.虽然C4H8、C2H4、C3H6的物质的量之比等于化学计量数之比,但不一定达平衡状态;
C.混合气体的总质量不变,物质的量不变,平均相对分子质量始终不变,反应不一定达平衡状态;
D.C4H8、C2H4、C3H6的浓度均不再变化,则表明反应达平衡状态;
综合以上分析,AD符合题意。答案为:AD;
Ⅱ.①该时间段内,n(C3H6)=nmol,则消耗n(C4H8)=0.5nmol,依题意![]() ,m=n,反应速率v(C4H8)=
,m=n,反应速率v(C4H8)=![]() =
= ![]() mol/(L·min)。答案为:
mol/(L·min)。答案为:![]() ;
;
②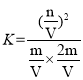 =0.5。答案为:0.5;
=0.5。答案为:0.5;
③设原平衡时,n(C4H8)=1mol,n(C2H4)=2mol,n(C3H6)=1mol,后加入的n(C4H8)=1mol,n(C2H4)=1mol,设参加反应的C4H8的物质的量为x,建立三段式:

K=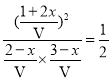 ,x=0.27mol,新平衡中C3H6的体积分数为
,x=0.27mol,新平衡中C3H6的体积分数为![]() =0.
=0.![]() 。答案为:>;
。答案为:>;
(3)①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。从压强与百分含量图看,温度在300~400℃之间比较好,从温度与百分含量图看,压强在0.3~0.5之间比较好,再结合选项,可确定最适宜的条件是选项C。答案为:C;
②图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从主反应3C4H8![]() 4C3H6看,压强增大,丙烯的百分含量减小,无法解释丙烯百分含量增大的事实;但从副反应C4H8
4C3H6看,压强增大,丙烯的百分含量减小,无法解释丙烯百分含量增大的事实;但从副反应C4H8![]() 2C2H4看,增大压强,平衡逆向移动,丙烯的浓度增大,再考虑对主反应的影响,就容易解释丙烯的分含量随压强增大呈上升趋势的原因。从而得出从平衡角度解释其可能的原因是压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。答案为:压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。
2C2H4看,增大压强,平衡逆向移动,丙烯的浓度增大,再考虑对主反应的影响,就容易解释丙烯的分含量随压强增大呈上升趋势的原因。从而得出从平衡角度解释其可能的原因是压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。答案为:压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,丙烯含量增大。