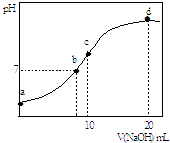
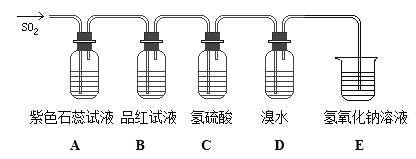
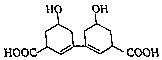
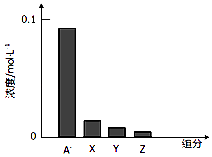
��Ŀ����
����Ŀ��Ϊ�˲ⶨij�����Ũ�ȣ���0.2molL��1��̼���Ʊ�Һ�������з�Ӧ��Ϊ����480mL�ı�Һ��ijͬѧ���������в�����������
��1����ҡ�Ⱥ���������ˮ���̶���1cm�������ý�ͷ�ιܼ�ˮ�� ֹ��Ȼ�����ƿ����������ָ�����Լ�ƿ�ڣ�
�����ձ���ע��Լ100mLˮ���ڽ����ºܿ��ܽ��꣮
��������ˮϴ�����ձ�3�Σ���ϴ��Һע���˷�Һ���ڣ�
�ܽ����º����Һ�ز�����ע�� �У� ������ƽ���� ��̼���Ʒ�ĩ������250mL���ձ��У�
��2����ͬѧ������ȷ��˳���� �����ţ�
��3����ͬѧ�IJ������������Ǵ��ģ����ţ�������������Һ��Ũ�� 0.2molL��1 �� ����=������������
���𰸡�
��1����Һ����ʹ���̶������У�500mL��10.6
��2���ݢڢܢۢ�
��3���ۣ���
���������⣺�ٶ���ʱ��ֱ�Ӽ�����ˮ����̶���1��2cm�����ý�ͷ�ι���εμӵ���Һ����ʹ���̶�������Ϊֹ��
���Դ��ǣ���Һ����ʹ���̶������У�����Ҫ480mL��Һ��Ӧѡ��500mL����ƿ����Ҫ���ʵ�����m=0.2molL��1��0.5L��106g/mol=10.6g��
���Դ��ǣ�10.6����1������һ�����ʵ�Ũ����Һ��һ�㲽��Ϊ�����㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ��װƿ��������ȷ��˳��Ϊ���ݢڢܢۢ٣�
���Դ��ǣ��ݢڢܢۢ٣���2��Ϊ��֤ʵ��ɹ���Ӧ����������ȫ��ת�Ƶ�����ƿ�����������ˮϴ�����ձ�3�Σ���ϴ��Һע���˷�Һ���ڣ��������ʲ�����ģ����ʵ����ʵ���ƫС������C= ![]() ��֪����ҺŨ��ƫ�ͣ����Ԣ۲�������Ӧ��ϴҺȫ��ת�Ƶ�����ƿ�У�
��֪����ҺŨ��ƫ�ͣ����Ԣ۲�������Ӧ��ϴҺȫ��ת�Ƶ�����ƿ�У�
���Դ��ǣ��ۣ�����
�����㾫�����������⣬������Ҫ�˽�����һ�����ʵ���Ũ�ȵ���Һ(�������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶���)��