题目内容
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和一定浓度的盐酸溶液。根据这两种溶液的配制情况回答下列问题:

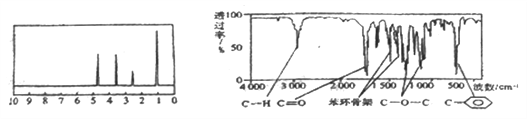
(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号)。
(2)在配制NaOH溶液时:
填写下列表格:
应称取NaOH的质量/g | 应选用容量瓶的规格/mL |
__________________ | __________________ |
(3)容量瓶上需标有以下五项中的_________________(填序号)。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)下列配制的溶液浓度偏低的是________________________(填序号)。
A.配制前,容量瓶中有少量蒸馏水
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
(5)下图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/mL
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为_________molL-1。
②取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是____________
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有_________影响?(在横线上填“偏大”、“偏小”、“无影响”)。
Ⅰ溶液注入容量瓶前没有冷却至室温________
Ⅱ 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水_________
【答案】AC 6.0 500mL容量瓶 ① ③ ⑤ BC 11.9 BD 偏高 偏低
【解析】
(1)所用仪器有:托盘天平、量筒、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等,所以A、C不需要;
故答案是:AC;
(2)①要配制0.3mol·L-1 NaOH溶液480mL,应选择500mL容量瓶,需要氢氧化钠质量=0.3mol·L-1×0.5L×40g·mol-1=6.0g,配制480mL溶液,需要500mL容量瓶,
故答案为:6.0;500mL容量瓶;
(3)容量瓶上需标有以下五项中的①温度 ③容量 ⑤刻度线,故选:① ③ ⑤;
(4)A.配制前,容量瓶中有少量蒸馏水,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故A错误;
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.加蒸馏水时不慎超过了刻度线,说明实验失败,应该洗净容量瓶后重新配制,配制的溶液浓度偏低,故C正确;
D.用胶头滴管加水定容时俯视刻度,导致配制时加入的蒸馏水体积偏小,配制的溶液浓度偏高,故D错误;
故选BC。
(5)①该浓盐酸的物质的量浓度为:c=![]() mol·L-1=11.9mol·L-1,故答案为:11.9;
mol·L-1=11.9mol·L-1,故答案为:11.9;
②取用任意体积的该盐酸溶液时,溶液的物质的量浓度、溶液的密度为定值,与溶液的体积无关,而溶液中氯离子的物质的量、氯离子数目与溶液的体积有关,
故答案为:BD;
③在配制过程中,Ⅰ溶液注入容量瓶前没有冷却至室温,冷却后溶液体积变小,溶液浓度偏高;Ⅱ 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,配制的溶液浓度偏低。
故答案为:偏高;偏低。