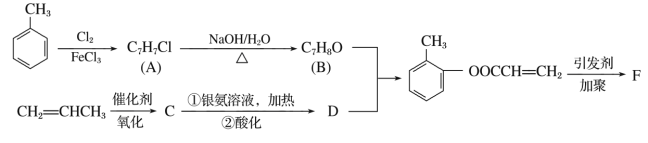
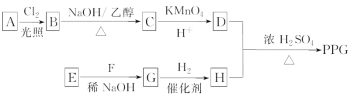
题目内容
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属同一族,它们原子的最外层电子排布式为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是________。
(2)由这5种元素组成的一种化合物是(写化学式)______________________。写出该物质的一种主要用途:_________________________________________
(3)写出C元素基态原子的电子排布式:_______________________________。
(4)用电子排布图表示D元素原子的最外层电子排布:________________。
【答案】H O Al S K KAl(SO4)2·12H2O 净水剂 1s22s22p63s23p1 
【解析】
A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素;C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数大于O,故C为Al元素;A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,E为金属,E的原子序数大于S元素,故E为K元素,由于C、E是金属元素,则A为H元素,据此分析。
A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素;C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数大于O,故C为Al元素;A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,E为金属,E的原子序数大于S元素,故E为K元素,由于C、E是金属元素,则A为H元素。
(1)由以上分析可知A为H,B为O,C为Al,D为S,E为K;
(2)由这五种元素组成的一种化合物是KAl(SO4)212H2O;可作为净水剂;
(3)C为Al原子,基态原子的电子排布式为:1s22s22p63s23p1;
(3)D为S元素,原子价层电子排布为ns2np4,轨道表示式为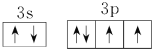 。
。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。