题目内容
(14分)A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。
(1)D的原子结构示意图为__________________,丙的电子式为____________________,E在周期表中的位置为_____________。
(2)下列说法正确的有__________________________
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应____________。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
___________________________________________________________________
(1)D的原子结构示意图为__________________,丙的电子式为____________________,E在周期表中的位置为_____________。
(2)下列说法正确的有__________________________
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应____________。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
___________________________________________________________________
⑴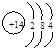 (2分)
(2分) 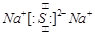 (2分)第三周期
(2分)第三周期 族(2分)
族(2分)
⑵①② (2分)
⑶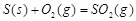 ;
;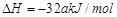 (2分)
(2分)
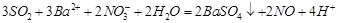 (2分)
(2分)
⑷ 或
或
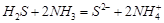 或
或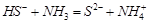 (2分)及其他合理答案
(2分)及其他合理答案
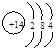 (2分)
(2分) 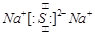 (2分)第三周期
(2分)第三周期 族(2分)
族(2分)⑵①② (2分)
⑶
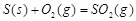 ;
;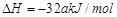 (2分)
(2分)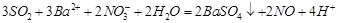 (2分)
(2分)⑷
 或
或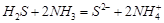 或
或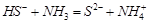 (2分)及其他合理答案
(2分)及其他合理答案A是原子半径最小的元素,A是H,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲为NH4NO3,B是N;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,乙是SiH4,D是Si,E与B同主族,E为P,C的阳离子与F的阴离子
相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。C是Na, F为S.
⑴
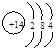 (2分)
(2分) 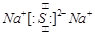 (2分)第三周期
(2分)第三周期 族(2分)
族(2分)⑵①② (2分)
⑶1g F在空气中完全燃烧放出a kJ的热量,1molS放出32aKj,
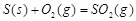 ;
;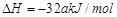 (2分)
(2分)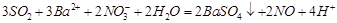 (2分)
(2分)⑷
 或
或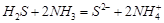 或
或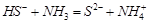 (2分)及其他合理答案
(2分)及其他合理答案
练习册系列答案
相关题目
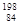 Po和
Po和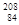 Po互为同位素
Po互为同位素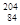 Po和
Po和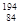 Po中子数差为20
Po中子数差为20 Po和
Po和 Po的核外电子总数相同,但不是同一种核素
Po的核外电子总数相同,但不是同一种核素