题目内容
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g) + 2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H2
CH3OH(g) + H2O(g) △H2
③CO2(g) + H2(g)![]() CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=_____kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_______kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_____;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母)。
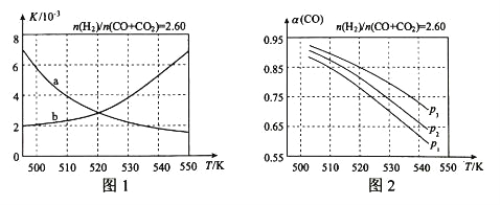
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α与温度和压强的关系如图2所示。 α(CO)值随温度升高而_______(填“增大”或“减小”)。图2中的压强由大到小为___________________。
【答案】 -99 +41 ![]()
![]() 减小
减小 ![]()
【解析】(1)、反应热=反应物总键能生成物总键能,故△H1=1076kJ.mol1+2×436kJ.mol1(3×413+343+465)kJ.mol1=99kJ.mol1;
根据盖斯定律:②①=③,故△H3=△H2△H1=58kJ.mol1(99kJ.mol1)=+41kJ.mol1,
故答案为:99;+41;
(2)、反应①为CO(g)+2H2(g)CH3OH(g),根据平衡常数的定义,则平衡常数为![]() ,故答案为:
,故答案为: ![]() ;
;
根据(1)中的计算可知,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故曲线a正确反映平衡常数K随温度变化关系,
故答案为: ![]() ;
; ![]() 。
。
(3)、由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P3>P2>P1,
故答案为:减小;P3>P2>P1。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案