题目内容
【题目】月球土壤中含有H、Ne、Na、Mg、Si、S、Cl、Cu等多种元素,是人类未来的资源宝库,回答下列问题:
(1)在下列电子构型中,属于Na原子的激发态构型的是______
A.1s22s22p63s1 B.1s2s22p63p1
C.1s22s22p63s13p1 D.1s22s22p43s3
(2)基态Na、Na+、O、Ne电离最外层一个电子所需能量从小到大的顺序为_________
(3)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,其电离方程式为I2C16![]() ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
(4)在[ Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH______,(填“大”“小”或“相等"),原因是_______
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的O2-组成的多面体的形状为_____,MgO的熔点高于Na2O的原因是_________
(6)硅的晶体结构属于金刚石型,晶胞如图所示。已知其密度为ρgcm-3 ,设NA为阿伏加德罗常数的值,则晶胞参数a=_____nm,晶体中Si—Si 键的键长为_______ nm(用含 p、NA的代数式表示)。

【答案】B Na<O<Ne<Na+ V形(角形、折线形) sp3 大 氨分子与Cu2+形成配合物后,孤对电子与Cu2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱,故H-N-H键角变大 八面体(或正八面体) MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大,故MgO的熔点高于Na2O 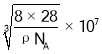
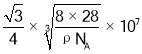
【解析】
(1)A. 1s22s22p63s1是Na原子的基态;B.1s2s22p63p1是Na原子的激发态;C.1s22s22p63s13p1不是Na原子的电子排布式;D.1s22s22p43s3中3s轨道最多只能排布2个电子。
(2)基态Na易失去1个电子,因为核外电子数相同,而Na+的质子数比Ne的质子数多1,对核外电子的控制能力更强,所以Na+的失去最外层一个电子比Ne的失去最外层一个电子大,O、Ne,同周期从左到右失去电子越来越难。
(3)ICl2+离子价层电子对数为![]() 。
。
(4)氨分子与Cu2+形成配合物后,孤对电子与Cu2+成配位键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱。
(5)MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大。
(6)先计算晶胞中Si原子个数,根据密度公式计算得到晶胞参数,晶体中Si—Si键的键长为体对角线的四分之一。
(1)A. 1s22s22p63s1是Na原子的基态,故A不符合题意;B.1s2s22p63p1是Na原子的激发态,故B符合题意;C.1s22s22p63s13p1不是Na原子的电子排布式,故C不符合题意;D.1s22s22p43s3中3s轨道最多只能排布2个电子,故D不符合题意;综上所述,答案为B。
(2)基态Na易失去1个电子,因为核外电子数相同,而Na+的质子数比Ne的质子数多1,对核外电子的控制能力更强,所以Na+的失去最外层一个电子比Ne的失去最外层一个电子大,O、Ne,同周期从左到右失去电子越来越难,因此电离最外层一个电子所需能量从小到大的顺序为Na<O<Ne<Na+;故答案为:Na<O<Ne<Na+。
(3)ICl2+离子价层电子对数为![]() ,立体构型为“V”形,因此中心原子的杂化类型是sp3;故答案为:V形(角形、折线形);sp3。
,立体构型为“V”形,因此中心原子的杂化类型是sp3;故答案为:V形(角形、折线形);sp3。
(4)在[Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH大,原因是氨分子与Cu2+形成配合物后,孤对电子与Cu2+成配位键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱,故∠HNH键角变大;故答案为:大;氨分子与Cu2+形成配合物后,孤对电子与Cu2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥作用减弱,故H—N—H键角变大。
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的6个O2组成的多面体的形状为正八面体,MgO的熔点高于Na2O的原因是MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大,故MgO的熔点高于Na2O;故答案为:八面体(或正八面体);MgO与Na2O均为离子晶体,r(Mg2+)<r(Na+),MgO的键长比Na2O键长短,键能大,MgO的晶格能大,故MgO的熔点高于Na2O。
(6)硅的晶体结构属于金刚石型,已知其密度为ρgcm-3 ,设NA为阿伏加德罗常数的,晶胞中Si原子个数为![]() ,则
,则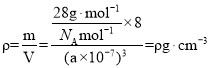 ,晶胞参数a=
,晶胞参数a=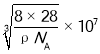 nm,晶体中Si—Si键的键长为体对角线的四分之一,因此晶体中Si—Si键的键长
nm,晶体中Si—Si键的键长为体对角线的四分之一,因此晶体中Si—Si键的键长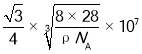 nm;故答案为:
nm;故答案为: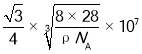 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案