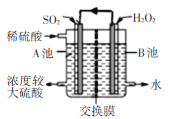
题目内容
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
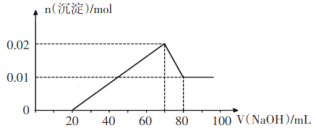
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
【答案】C
【解析】
根据无色溶液,则肯定没有Fe3+;根据②滴加一定浓度的NaOH溶液的图示,得到0~20ml没有沉淀生成,为NaOH与H+反应,则肯定有H+,沉淀生成后立即减少,说明溶液中无![]() ,70~80ml沉淀溶解为Al(OH)3+OH-=AlO
,70~80ml沉淀溶解为Al(OH)3+OH-=AlO![]() +2H2O,且Al(OH)3为0.01mol,说明10mlNaOH溶液含有0.01molNaOH,溶液中有Al3+为0.01mol,则还有0.01mol沉淀为Mg(OH)2,得到溶液中有Mg2+为0.01mol,则溶液中无
+2H2O,且Al(OH)3为0.01mol,说明10mlNaOH溶液含有0.01molNaOH,溶液中有Al3+为0.01mol,则还有0.01mol沉淀为Mg(OH)2,得到溶液中有Mg2+为0.01mol,则溶液中无![]() ,根据NaOH溶液体积关系可知含H+为0.02mol;根据①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03mol,则沉淀为硫酸钡,则
,根据NaOH溶液体积关系可知含H+为0.02mol;根据①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03mol,则沉淀为硫酸钡,则![]() 为0.03mol,由于加入的为BaCl2溶液,所以滴加AgNO3溶液有白色沉淀生成,不能确定原溶液是否含有Cl-;③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色,溶液中还含有
为0.03mol,由于加入的为BaCl2溶液,所以滴加AgNO3溶液有白色沉淀生成,不能确定原溶液是否含有Cl-;③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色,溶液中还含有![]() ,铜与H+和
,铜与H+和![]() 反应生成无色的一氧化氮气体,遇氧气后形成红棕色的二氧化氮。阴离子浓度相同,则NO3-的物质的量也为0.03mol,则阴离子所带负电荷的物质的量=0.03mol×2+0.03mol×1=0.09mol;现确定的阳离子所带正电荷的物质的量=0.01mol×3+0.01mol×2+0.02mol=0.07mol,可知一定含有根据电荷守恒,一定含有K+。
反应生成无色的一氧化氮气体,遇氧气后形成红棕色的二氧化氮。阴离子浓度相同,则NO3-的物质的量也为0.03mol,则阴离子所带负电荷的物质的量=0.03mol×2+0.03mol×1=0.09mol;现确定的阳离子所带正电荷的物质的量=0.01mol×3+0.01mol×2+0.02mol=0.07mol,可知一定含有根据电荷守恒,一定含有K+。
A.根据分析可知,该溶液中一定存在H+、Mg2+、Al3+、![]() 、
、![]() 、K+,可能存在Cl-,A错误;
、K+,可能存在Cl-,A错误;
B..由于无法得到Cl-的浓度,所以c(K+)也无法计算,B错误;
C.根据分析10mlNaOH溶液含有0.01molNaOH,NaOH溶液浓度为![]() =1mol/L,C正确;
=1mol/L,C正确;
D.溶液中含有NO3-的物质的量为0.03mol,H+的物质的量为0.02mol,根据离子方程式3Cu2++8H++2NO3-=3Cu2++2NO↑+4H2O,H+不足,根据H+的量计算铜的质量,则试管3中溶解的铜粉质量![]() ,D错误;
,D错误;
答案选C。

【题目】某物质 A 是 B(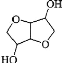 )的同分异构体,7.30 g 的 A 与足量饱和碳酸氢钠可释放出 2.24L 二氧化碳(标准状况),A 的可能结构共有( )种(不考虑立体异构)
)的同分异构体,7.30 g 的 A 与足量饱和碳酸氢钠可释放出 2.24L 二氧化碳(标准状况),A 的可能结构共有( )种(不考虑立体异构)
A.8B.9C.10D.11
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。某小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示:
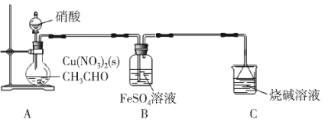
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:
乙醛 | 乙二醛 | 乙二酸 | 乙酸 | |
沸点/℃ | 20.8 | 50.5 | 109 | 117.9 |
溶解性 | 与水、有机溶剂互溶 | 溶于水、乙醇等 | 溶于水和有机溶剂 | 与水、乙醇互溶 |
密度/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
相对分子质量 | 44 | 58 | 90 | 60 |
实验步骤:
①取20 mL乙醛装于烧瓶,加入2 g Cu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2 mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0 mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是___________。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为________________。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是___________;判断烧瓶中制备乙二醛的反应已完成的标志是___________。
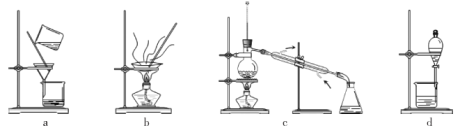
(4)分离提纯产品,宜选择下列装置___________(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为___________(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取V mL产品,加蒸馏水稀释至250 mL,量取25.00 mL稀释后的溶液于锥形瓶,滴加5.00 mL稀硫酸,用c mol·L-1 KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
实验 | Ⅰ | Ⅱ | Ⅲ |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
滴定终点的标志是___________;该产品纯度为___________g·mL-1(用含V和c的代数式表示)。