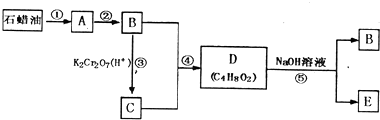
题目内容
20.将1mol H2S和a mol O2置于一密闭容器中,在120℃下进行反应,测得产物中既有S又有SO2,则此时容器内气体的物质的量之和为( )| A. | (a-0.5)mol | B. | (a+0.5)mol | C. | (1+0.5a)mol | D. | (1-0.5a)mol |
分析 由于产物中既有S又有SO2,所以1mol H2S和a mol O2恰好完全反应,由题意可知反应方程为:H2S+aO2=$\frac{3-2a}{2}$S+$\frac{2a-1}{2}$SO2+H2O,在120℃下进行反应,水是气体,由此分析解答.
解答 解:由于产物中既有S又有SO2,所以1mol H2S和a mol O2恰好完全反应,由题意可知反应方程为:H2S+aO2=$\frac{3-2a}{2}$S+$\frac{2a-1}{2}$SO2+H2O,所以容器内气体的物质的量之和为$\frac{2a-1}{2}$+1=(a+0.5)mol,故选B.
点评 本题考查了有关反应物过量的计算,题目难度中等,正确书写反应原理为解答本题的关键,明确反应物过量对反应产物的影响,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
10.离子液体(Ionic Iiquid),是指由有机阳离子和阴离子构成的在室温下呈液态的盐类化合物,具有蒸汽压低、熔点低、液程宽、易操作、可溶性好和稳定性高等特征,正逐步应用于科技和社会生活领域.一种合成“离子液体”的原料咪唑: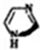 ,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )
,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )
 ,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )
,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )| A. | 是芳香族化合物 | |
| B. | 能发生加成、取代、氧化反应 | |
| C. | 每个分子中有9个σ键 | |
| D. | 分子极性键又含有非极性键中既含有 |
8. 石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
 石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A. | 石墨烯与金刚石互为同位素 | |
| B. | 0.12g石墨烯中含有6.02×1021个碳原子 | |
| C. | 石墨烯中的碳原子间以共价键结合 | |
| D. | 石墨烯是一种新型有机物 |
15.下列实验操作,现象和结论均正确的是
| 实验操作 | 现象 | 结论 | |
| A | 稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中产生白色胶状沉淀 | 非金属性:S>C>Si |
| B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 | 看到一条光亮的“通路” | 证明生成了氢氧化铁沉淀 |
| D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡、静置 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
12.A元素原子的M层有3个电子,B元素原子的L层有6个电子,则A,B两元素形成的化合物的化学式式量为( )
| A. | 59 | B. | 102 | C. | 114 | D. | 150 |
17.某有机物在氧气力充分燃烧,生成的CO2和H2O的物质的量之比为1:2,由此可以得出的结论是( )
| A. | 该有机物一定含有氧元素 | B. | 该有机物一定不含氧元素 | ||
| C. | 该有机物一定是甲烷 | D. | 该有机物可能是甲烷 |
18.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行实验如表所示:
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其变化,测其密度是相同条件下H2的45倍 | (1)A的相对分子质量为90 |
| (2)将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为C3H6O3 |
| (3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况) | (3)用结构简式表示A中含有的官能团羧基、羟基 |
(4)A的核磁共振氢谱如图: | (4)综上所述,A的结构简式为 |
(5)已知两分子A在一定条件下可生成六元环状酯,写出该反应的化学方程式:2 $→_{△}^{浓硫酸}$ $→_{△}^{浓硫酸}$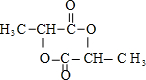 +2H2O. +2H2O. | |