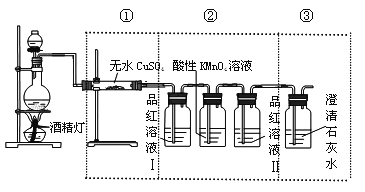
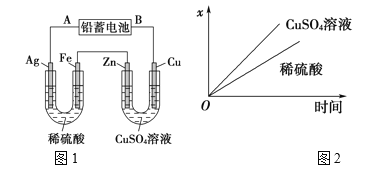
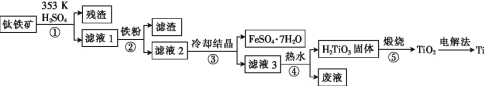
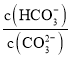题目内容
【题目】新型超高能材料是国家核心军事力量制高点的重要标志,高性能炸药BNCP的结构如图,回答下列问题:
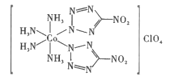
(1)BNCP中Co3+的基态价层电子轨道表示式是__,Co3+的配位数是__,阴离子ClO4-的中心原子杂化类型是__。
(2)1mol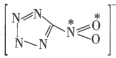 配体中的σ键的数目是__,已知该配体是平面结构,图中标记的N原子与O原子之间的σ键是由N原子的__杂化轨道与O原子的__轨道重叠形成的。
配体中的σ键的数目是__,已知该配体是平面结构,图中标记的N原子与O原子之间的σ键是由N原子的__杂化轨道与O原子的__轨道重叠形成的。
(3)比较NO2+、NO2、NO2-的键角大小:__,与NO2-互为等电子体的单质是___。
(4)比较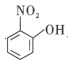 、
、![]() 的沸点并说明理由:__。
的沸点并说明理由:__。
(5)比较H2O与OF2的极性大小并说明理由:__。
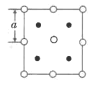
(6)2018年南京理工大学胡炳成团队合成全国首个全氮阴离子,全氮阴离子的盐AgN5的晶体结构中:N5-采取面心立方最密堆积,Ag+填在正四面体空隙中,从晶胞上方的俯视投影图如图。每个晶胞中含有的N5-的数目是__。Ag+与N5-最近的距离是__(用a表示)。
【答案】![]() 6 sp3 8NA sp2 2p NO2+>NO2>NO2- O3
6 sp3 8NA sp2 2p NO2+>NO2>NO2- O3 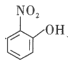 <
<![]() H2O的极性大于OF2,H2O和OF2都是V形结构,H和O的电负性的差值大于O和F之间的电负性差值,则H2O的极性更大 4
H2O的极性大于OF2,H2O和OF2都是V形结构,H和O的电负性的差值大于O和F之间的电负性差值,则H2O的极性更大 4 ![]() a
a
【解析】
(1)根据价层电子轨道排布方式写出轨道表示式,由结构图可知Co3+的配位数,根据价层电子对互斥理论的杂化轨道计算公式得到ClO4-的杂化方式;
(2)每两个原子之间形成1个σ鍵,因为是平面结构,所以是N的sp2杂化轨道与O的2p轨道重叠形成σ键;
(3)NO2+是直线型结构,键角为180°,NO2和NO2-是sp2杂化V型结构,键角约为120°,其中NO2的N原子的其中一个杂化轨道上含一个单电子,NO2-的N原子杂化轨道上含一对电子,则排斥力更大,键角更小;
(4)苯环上羟基位置不同会形成不同种类的氢键,从而影响物质的沸点;
(5) H2O与OF2分子结构相似,比较O与H和F的电负性差值的相对大小进行判断;
(6)由图计算每个晶胞中含有的N5-的数目;该结构类似四方ZnS的结构,因此可以求算品胞中的离子数与阴阳离子的最近距离。
(1)Co为27号元素,Co3+核外有24个电子,基态价层轨道表示式为![]() ,由结构图可知Co3+的配位数为6,根据价层电子对互斥理论的杂化轨道计算公式得到ClO4-的杂化方式为sp3杂化;
,由结构图可知Co3+的配位数为6,根据价层电子对互斥理论的杂化轨道计算公式得到ClO4-的杂化方式为sp3杂化;
(2)每两个原子之间形成1个σ鍵,由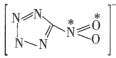 结构图可知,1mol配体中的σ键有8mol,即数目为8NA,因为是平面结构,所以是N的sp2杂化轨道与O的2p轨道重叠形成σ键;
结构图可知,1mol配体中的σ键有8mol,即数目为8NA,因为是平面结构,所以是N的sp2杂化轨道与O的2p轨道重叠形成σ键;
(3)NO2+是直线型结构,键角为180°,NO2和NO2-是sp2杂化V型结构,键角约为120°,其中NO2的N原子的其中一个杂化轨道上含一个单电子,NO2-的N原子杂化轨道上含一对电子,则排斥力更大,键角更小,所以三者键角大小关系为:NO2+>NO2>NO2-;1个NO2-有3个原子,核外有24个电子,与NO2-互为等电子体的单质是O3;
(4) 存在分子内氢键,而
存在分子内氢键,而![]() 存在分子间氢键,沸点更高;
存在分子间氢键,沸点更高;
(5)H2O的极性大于OF2,H2O和OF2都是V形结构,H和O的电负性的差值大于O和F之间的电负性差值,则H2O的极性更大;
(6)由图计算每个晶胞中含有的N5-的数目为4![]() +4
+4![]() +1=4;该结构类似四方ZnS的结构,因此可以求算品胞中的Ag+与N5-最近的距离是
+1=4;该结构类似四方ZnS的结构,因此可以求算品胞中的Ag+与N5-最近的距离是![]() =
=![]() a。
a。