题目内容
【题目】溶解氧(指溶解在水体中氧气分子)是衡量水质的一个重要指标。为测定某水样中溶解氧含量(ρ=![]() )设计了如下实验方案。实验步骤如下:
)设计了如下实验方案。实验步骤如下:
步骤1:水样的采集与固定
用水样瓶准确量取100mL的待测水样(不能留有气泡),并用针筒向水样下方快速注入2.0mLMnSO4溶液和3.0mL碱性KI溶液,盖好瓶盖,上下颠倒摇匀,此时生成Mn2+在碱性条件下被水中的氧气氧化为MnOOH棕色沉淀,静置至澄清。
步骤2:碘的游离
向水样瓶中加入3.0mL浓硫酸,使I-在酸性条件下被MnOOH氧化为I2,同时MnOOH被还原Mn2+,待沉淀完全溶解后,将它们全部转移到250mL锥形瓶中。
步骤3:碘的滴定
向锥形瓶中加入少量淀粉溶液,再滴加0.005mol·L-1的Na2S2O3标准溶液,恰好完全反应时,消耗Na2S2O3标准溶液的体积为16mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)MnOOH中Mn元素的化合价是___。
(2)写出步骤2中所发生反应的离子方程式___。
(3)若待测水样中留有气泡,则测定结果将___。(填“偏大”、“偏小”或“无影响”)
(4)计算该水样中溶解氧的含量ρ(以mg·L-1表示),并写出计算过程:___。
【答案】+3 2I-+2MnOOH+6H+=I2+2Mn2++4H2O 偏大 6.4mg·L-1
【解析】
该实验利用Mn2+在碱性条件下被水中的氧气氧化为MnOOH棕色沉淀,然后加入浓硫酸,使I-在酸性条件下被MnOOH氧化为I2,然后利用Na2S2O3标准溶液进行滴定,通过消耗的Na2S2O3标准溶液的量计算水中溶解氧的含量,以此进行分析。
(1)MnOOH中O呈-2价,H呈+1价,根据化合物化合价为0可知Mn元素的化合价为+3价;
(2)步骤2为酸性条件下I-与MnOOH发生氧化还原反应,I元素化合价从-1价升高为0价,Mn元素化合价从+3价降低为+2价,根据氧化还原反应得失电子守恒、电荷守恒、原子守恒可知其离子方程式为:2I-+2MnOOH+6H+=I2+2Mn2++4H2O;
(3)若待测液中含有水泡,即含有未溶解的氧气,则消耗的MnSO4增加,后续生成的I2会增加,最终滴定消耗的Na2S2O3标准溶液增加,最终测得的结果将偏大;
(4)整个过程中Mn2+反应前后未发生变化,根据整个得失电子守恒可列出关系式:
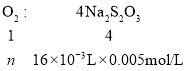
解得n(O2)=2×10-5mol,水样中溶解氧含量ρ=![]() =6.4mg·L-1。
=6.4mg·L-1。