题目内容
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是( )
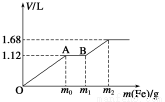
A.开始时产生的气体为H2
B.AB段产生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5 mol·L-1
D.参加反应铁粉的总质量m2=5.6 g
D
【解析】OA段:Fe+4H++NO3-=Fe3++NO↑+2H2O
AB段:2Fe3++Fe=3Fe2+
B以后:2H++Fe=H2↑+Fe2+
A项错,B项错。
C项,c(HNO3)=c(NO)= =1 mol·L-1,错误;
=1 mol·L-1,错误;
D项,由得失电子守恒得m(Fe)=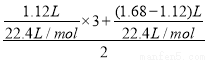 ×56=5.6 g,正确。
×56=5.6 g,正确。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断正确的是( )
氢氧化物 | 溶液pH | |||
开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | - | - |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |

A.C点的沉淀为Fe(OH)3
B.OA段可能发生的反应有:3Ba2++6OH-+3SO42-+2Fe3+=3BaSO4↓+2Fe(OH)3↓
C.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-=2BaSO4↓+Al(OH)3↓
D.据图计算原溶液中c(Cl-)>c(SO42-)
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1NaOH溶液 | pH=11 NaOH溶液 | 0.1mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)