题目内容
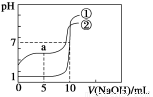
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1NaOH溶液 | pH=11 NaOH溶液 | 0.1mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
C
【解析】A项,NaOH完全电离,CH3COOH部分电离,前者对水的电离抑制程度大,故由水电离出的c(H+):①<③;B项,0.1 mol·L-1 CH3COOH溶液,稀释100倍,无法计算其pH值,错误;C项,c(CH3COO-)>c(H+)>c(Na+)>c(OH-)是CH3COOH过量很多的情况,正确;D项,①③若等体积混合,溶液呈碱性,若呈中性,则碱不足,即V(NaOH)<V(CH3COOH)。

 优百分课时互动系列答案
优百分课时互动系列答案从下列事实所得出的相应结论正确的是( )
| 实验事实 | 结论 |
① | 在相同温度下,向1 mL 0.2 mol·L-1 NaOH溶液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L-1 FeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
③ | 已知反应5Cl2+I2+6H2O=2HIO3+10HCl,2BrO3-+Cl2=2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
④ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
A.③④ B.②④ C.①②③ D.全部
有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性 锌锰电池 | 图Ⅱ 铅?硫 酸蓄电池 | 图Ⅲ 电解 精炼铜 | 图Ⅳ 银锌 纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag