题目内容
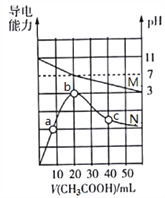
【题目】一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
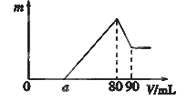
(1)80-90ml对应反应的离子方程式_____________;
(2)金属铝的质量为____________g;
(3)盐酸的体积是____________mL;
(4)a的取值范围是________________。
【答案】Al(OH)3+ OH-=AlO2-+2H2O 0.54g 80mL 0<a<50
【解析】
0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁,
(1)80~90ml为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(2)氢氧化钠的体积在80至90mL段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,根据质量守恒可以计算出氯化氢的物质的量,再根据V=![]() 计算出盐酸的体积;
计算出盐酸的体积;
(4)合金的组成可以采用极限假设法,当金属全部是金属铝时剩余的酸最多,a的值最大来判断a得取值范围。
(1)根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+ OH-=AlO2-+2H2O,即80~90ml对应反应的离子方程式为Al(OH)3+ OH-=AlO2-+2H2O;
(2)从横坐标80mL到90mL这段可以求出n(Al(OH)3)=n(OH-)=2 mol·L-1×0.01L=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,即为0.54g;
(3)镁、铝混合物投到盐酸中,生成氯化镁和氯化铝,并且从图上可知盐酸过量,当加入氢氧化钠溶液后,氢氧化钠先与过量的酸反应生成氯化钠,后氢氧化钠又与氯化镁和氯化铝反应生成氯化钠,当氢氧化钠溶液的体积为80mL时,盐酸中的氯离子都与钠离子结合成氯化钠,根据原子守恒可知,n(HCl)=n(NaOH)=2 mol·L-1×0.08L=0.16mol,则盐酸的体积为V=![]() =0.16mol÷2mol/L=0.08L=80mL;
=0.16mol÷2mol/L=0.08L=80mL;
(4)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为0<a<50。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案