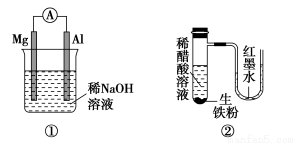
题目内容
现有铵盐样品A,是(NH4)2SO4、NH4HSO4的混合物。为确定A中各成分的含量,某研究性学习小组的同学取了数份相同质量的样品A溶于水,然后分别加入不同体积的1 mol/L的NaOH溶液,水浴加热至气体全部逸出(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图所示。分析该图象并回答下列问题:
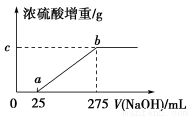
(1)写出ab段涉及的离子方程式:_____________________________。
(2)c点对应的数值是________;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为________。
(1)NH4++OH-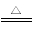 NH3↑+H2O
NH3↑+H2O
(2)4.25 9∶2
【解析】 (1)(NH4)2SO4、NH4HSO4的混合溶液显酸性,加入NaOH溶液,先发生酸碱中和反应,再发生NH4++OH- NH3↑+H2O。(2)根据图象可知,NH3的物质的量为0.25 mol,质量为4.25 g,NH4HSO4的物质的量为0.025 mol,则(NH4)2SO4的物质的量为0.112 5 mol,(NH4)2SO4、NH4HSO4的物质的量之比为9∶2。
NH3↑+H2O。(2)根据图象可知,NH3的物质的量为0.25 mol,质量为4.25 g,NH4HSO4的物质的量为0.025 mol,则(NH4)2SO4的物质的量为0.112 5 mol,(NH4)2SO4、NH4HSO4的物质的量之比为9∶2。

某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
物质 | 甲 | 乙 | CO | H2 |
燃烧热/(kJ·mol-1) | 1 366 | 5 518 | 283 | 286 |
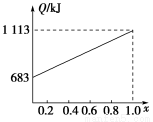
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
(1)乙的相对分子质量Mr(乙)=________。
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却到室温时,还剩余224 L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为________。甲、乙的分子式为:甲________;乙________。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO________mol。
根据表中信息,判断下列叙述中正确的是( )
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | / | Fe3+、Br2 |
|
② | KClO3 | 浓盐酸 | / | Cl2 |
|
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O