题目内容
1.某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验.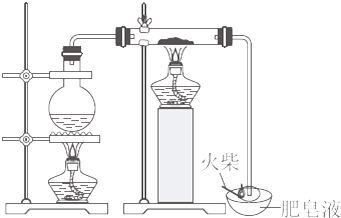
(1)用如图K8-2所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应).反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡破裂,有爆鸣声或“噗”的声音(填实验现象)时,
说明“铁与水蒸气”能够进行反应.
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解、过滤.向滤液中滴加KSCN溶液,观察溶液的颜色.在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满).
| 现象 | 结论与解释 | |
| 可能① | 溶液变为红色 | 混合物中含有+3价Fe,因为Fe3+遇KSCN变红色 |
| 可能② | 溶液为浅绿色 | 反应后的固体中可能含有+3价Fe,也可能不含有+3价Fe,因为若铁剩余较多,可将溶液中的Fe3+还原为Fe2+ |
a.Cl2和KSCN溶液
b.NaOH溶液
c.KMnO4溶液.
分析 (1)证明铁与水蒸气反应,只要证明反应中有氢气生成即可,可通过点燃法判断;
(2)反应后的固体中可能含有Fe和Fe3O4,溶于酸时可发生反应:Fe+2H+═Fe2++H2↑、Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+,由于混合物中Fe的量不确定,可能有两种情况:一是Fe较少,溶于酸后Fe3+有剩余,二是Fe较多,Fe3+完全被Fe还原为Fe2+,所以滤液中加KSCN溶液,可能变红也可能溶液为浅绿色;
(3)因为溶液中可能含有Fe3+,可利用Fe2+的还原性,用KMnO4溶液是否褪色进行检验.
解答 解:(1)要证明Fe与水蒸气反应,只要证明生成了H2就能说明,由实验装置和H2的检验方法可用点燃法观察是否有爆鸣声,
故答案为:肥皂泡破裂,有爆鸣声或“噗”的声音;
(2)反应后的固体混合物中可能含有Fe和Fe3O4,在溶于酸时可发生如下反应:Fe+2H+═Fe2++H2↑,Fe3O4+8H+═2Fe3++Fe2++4H2O,Fe+2Fe3+═3Fe2+,由于混合物中Fe的量不确定,可能有两种情况:一是Fe较少,溶于酸后Fe3+有剩余,二是Fe较多,Fe3+完全被Fe还原为Fe2+,所以滤液中加KSCN溶液,可能变红也可能溶液为浅绿色,
故答案为:①溶液变为红色;混合物中含有+3价Fe,因为Fe3+遇KSCN变红色;②溶液为浅绿色;反应后的固体中可能含有+3价Fe,也可能不含有+3价Fe,因为若铁剩余较多,可将溶液中的Fe3+还原为Fe2+;
(3)因为溶液中可能含有Fe3+,a、b试剂均不合适,可利用Fe2+的还原性,用KMnO4溶液紫色褪去,进而证明溶液中含有亚铁离子,故c正确,
故答案为:c.
点评 本题考查了铁及其化合物性质、性质实验方案的设计与评价,题目难度中等,注意掌握铁及其化合物性质,明确具有铁离子、亚铁离子的方法,特别是铁离子和亚铁离子同时存在时检验亚铁离子的方法,为高考热点.

 阅读快车系列答案
阅读快车系列答案| A. | 0价 | B. | +1价 | C. | -1价 | D. | -2价 |
| A. | 用1L水里含有溶质物质的量来表示的浓度叫做物质的量浓度 | |
| B. | 用一定量溶液里含有溶质的多少来表示的浓度叫做物质的量浓度 | |
| C. | 用1L溶液里含有溶质的量来表示的浓度叫做物质的量浓度 | |
| D. | 用1L溶液里含有多少摩尔溶质来表示的浓度叫做物质的量浓度 |
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a>b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 密闭容器中X和Y的物质的量之比为1:2时,该反应达到化学平衡状态 |
| 元素 | I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 甲 | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
| 乙 | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
| 丙 | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16091 |
| 丁 | 1251.2 | 2298 | 3822 | 5158.6 | 6542 |
| A. | 甲的金属性比乙强,且甲和乙的最高价氧化物的水化物可以相互反应 | |
| B. | 乙的最外层电子轨道表达式: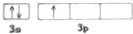 | |
| C. | 丙的最高价氧化物性质稳定,属于原子晶体,常温下不和强酸、强碱、强氧化剂反应 | |
| D. | 丁的常见的气态氢化物一定是极性分子 |
| A. | 碳棒上有气体放出,溶液pH变大 | B. | a是正极,b是负极 | ||
| C. | 电子从a极流向b极 | D. | a极上发生了氧化反应 |
| A. | 氡是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡气因其具有放射性而对人体有害 | |
| D. | 222Rn、219Rn、220Rn是三种同素异形体 |
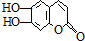 (碳、氢原子未画出,每个折点代表一个碳原子),它具有抗菌作用.1mol该物质与浓溴水作用和足量的NaOH溶液反应分别消耗的物质的量为( )
(碳、氢原子未画出,每个折点代表一个碳原子),它具有抗菌作用.1mol该物质与浓溴水作用和足量的NaOH溶液反应分别消耗的物质的量为( )| A. | 2moL,2moL | B. | 3 moL,3 moL | C. | 3 moL,4 moL | D. | 2 moL,4 moL |