题目内容
12.下表是第三周期部分主族元素的电离能数据:| 元素 | I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 甲 | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
| 乙 | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
| 丙 | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16091 |
| 丁 | 1251.2 | 2298 | 3822 | 5158.6 | 6542 |
| A. | 甲的金属性比乙强,且甲和乙的最高价氧化物的水化物可以相互反应 | |
| B. | 乙的最外层电子轨道表达式: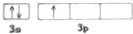 | |
| C. | 丙的最高价氧化物性质稳定,属于原子晶体,常温下不和强酸、强碱、强氧化剂反应 | |
| D. | 丁的常见的气态氢化物一定是极性分子 |
分析 第三周期部分主族元素中,甲的第二电离剧增,则价为第IA族元素,故甲为Na;乙元素第四电离能剧增,是ⅢA族元素,故乙为Al;丙的第四电离能剧增,处于ⅣA族,故丙为Si;丁元素第一电离能到第五电离能,依次相差不是很大,说明最外层有5个电子,故丁为P元素,据此解答.
解答 解:第三周期部分主族元素中,甲的第二电离剧增,则价为第IA族元素,故甲为Na;乙元素第四电离能剧增,是ⅢA族元素,故乙为Al;丙的第四电离能剧增,处于ⅣA族,故丙为Si;丁元素第一电离能到第五电离能,依次相差不是很大,说明最外层有5个电子,故丁为P元素.
A.Na的金属性比Al强,甲和乙的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,故A正确;
B.乙原子最外层电子数排布为3s23p1,最外层电子轨道表达式: ,故B正确;
,故B正确;
C.丙的最高价氧化物为二氧化硅,属于原子晶体,常温下不和强酸、强氧化剂反应,能与强碱反应,故C错误;
D.丁的常见的气态氢化物为PH3,为三角锥形结构,一定是极性分子,故D正确,
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解电离能与最外层电子数关系,难度中等.

练习册系列答案
相关题目
2.下列物质与HNO3反应时,硝酸既表现出强氧化性又表现出酸性的是( )
| A. | Fe2O3 | B. | FeS | C. | Cu(OH)2 | D. | C |
20.由两种短周期元素X和Y可组成化合物XY3,当X的原子序数为m时,Y的原子序数可能为( )
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①③④⑤⑥ | D. | ①②③④⑤⑥ |
7.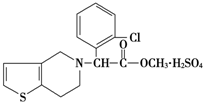 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质难溶于水 | |
| C. | 波立维能形成硫酸氢盐是与其结构中的氮原子有关 | |
| D. | 它可以与NaOH溶液反应,1 mol该物质最多可消耗2mol NaOH |
1.某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验.
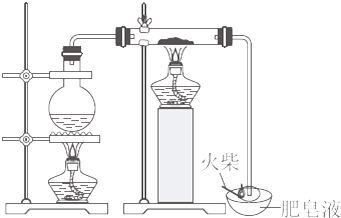
(1)用如图K8-2所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应).反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡破裂,有爆鸣声或“噗”的声音(填实验现象)时,
说明“铁与水蒸气”能够进行反应.
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解、过滤.向滤液中滴加KSCN溶液,观察溶液的颜色.在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满).
(3)将反应后固体溶于足量的盐酸中充分溶解,可选用c试剂证明溶液中含有Fe2+.
a.Cl2和KSCN溶液
b.NaOH溶液
c.KMnO4溶液.

(1)用如图K8-2所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应).反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡破裂,有爆鸣声或“噗”的声音(填实验现象)时,
说明“铁与水蒸气”能够进行反应.
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解、过滤.向滤液中滴加KSCN溶液,观察溶液的颜色.在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满).
| 现象 | 结论与解释 | |
| 可能① | 溶液变为红色 | 混合物中含有+3价Fe,因为Fe3+遇KSCN变红色 |
| 可能② | 溶液为浅绿色 | 反应后的固体中可能含有+3价Fe,也可能不含有+3价Fe,因为若铁剩余较多,可将溶液中的Fe3+还原为Fe2+ |
a.Cl2和KSCN溶液
b.NaOH溶液
c.KMnO4溶液.
8.人生病时要合理用药.下列药品与其作用相匹配的是 ( )
| A. | 阿司匹林:消炎抗菌 | B. | 氢氧化铝:中和过多胃酸 | ||
| C. | 青霉素:解热镇痛 | D. | 医用碘酒:人体补碘 |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O | |
| B. | 向AgNO3溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| C. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |