题目内容
2.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)写出C元素氢化物的电子式
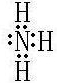 .
.(3)C和D两种元素氢化物的稳定性更强的是H2O>NH3(填物质的化学式)
(4)用电子式表示离子化合物EG的形成过程
 .
.
分析 由元素在短周期中的位置,可知A为H、B为C、C为N、D为O、E为Na、F为Al、G为Cl元素.
(1)由F的位置可知,F处于第三周期ⅢA族;
(2)C元素氢化物为氨气,为共价化合物;
(3)元素非金属性越强,其氢化物越稳定;
(4)NaCl由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成.
解答 解:由元素在短周期中的位置,可知A为H、B为C、C为N、D为O、E为Na、F为Al、G为Cl元素.
(1)F的位置可知,F为Al元素,处于第三周期ⅢA族,故答案为:三;ⅢA;
(2)C元素氢化物为氨气,为共价化合物,电子式为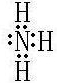 ,故答案为:
,故答案为: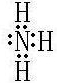 ;
;
(3)非金属性O>N,元素非金属性越强,其氢化物越稳定,则稳定性H2O>NH3,故答案为:H2O>NH3;
(4)氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成,NaCl的形成过程为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,侧重考查元素周期表结构、元素周期律、物质性质的考查,熟练掌握元素周期律知识,知道非金属性强、金属性强弱判断方法,答题时注意电子式的书写,题目难度不大.

练习册系列答案
相关题目
12.下列有关说法正确的是( )
| A. | NH3(g)+HCl(g)→NH4Cl(s),该反应可自发进行,故熵值增大 | |
| B. | SO2(g)→S(s)+O2(g)△H>0,△S<0.则该反应能自发进行 | |
| C. | O2(g)+2H2(g)═2H2O(l)△H<0,恒温恒压下一定能自发进行 | |
| D. | 某温度下2SO2(g)+O2(g)═2SO3(g),K1=400,则相同温度下2SO3(g)?2SO2(g)+O2(g)的平衡常数为$\frac{1}{400}$ |
13.下列有机物的命名正确的是( )
| A. | 2,4,6-三硝基甲苯 | B. | 3-甲基-1,3-丁二烯 | ||
| C. | 1,1,2,2-四甲基戊烷 | D. | 2-甲基-3-丁醇 |
14.下列说法中,正确的是( )
| A. | 放热反应的发生均无需加热 | |
| B. | 需要加热后才能发生的反应均是吸热反应 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 物质发生化学反应都伴随着能量变化 |
11.将如图所示实验装置的K闭合,下列判断正确的是( )


| A. | Cu电极上发生氧化反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(K+)增大 | D. | 片刻后可观察到滤纸a点变红色 |
13.下列说法不正确的是( )
| A. | 最外层电子数为次外层电子数一半的短周期主族元素只有Li、Si两种元素 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素 | |
| C. | 同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25 | |
| D. | 若主族元素的族序数为a,周期数为b,当$\frac{a}{b}$<1,该元素为非金属元素 |

 .
. +(n-1)H2O
+(n-1)H2O