题目内容
【题目】如图所示是工业生产硝酸铵的流程图. 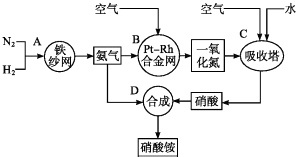
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是
(3)写出B中的反应方程式: .
(4)写出D中的反应方程式: .
(5)吸收塔C中通入空气的目的是 .
【答案】
(1)N2+3H2 ![]() 2NH3
2NH3
(2)催化剂
(3)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(4)NH3+HNO3=NH4NO3
(5)利用空气中的氧气将NO氧化
【解析】解:从流程图可知,N2和H2在红热铁砂网的催化作用下合成氨气,氨气和空气中的O2在铂铑合金网的催化作用下发生催化氧化生成NO和H2O,将NO和空气、水混合,NO和O2和水反应生成HNO3 , 然后NH3和HNO3反应生成NH4NO3 . (1)N2和H2在红热铁砂网的催化作用下合成氨气,化学方程式为:N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,所以答案是:催化剂;(3)B装置中在Pt﹣Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2
2NH3;(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,所以答案是:催化剂;(3)B装置中在Pt﹣Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:4NH3+5O2
4NO+6H2O,所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(4)在D中,NH3和HNO3反应生成NH4NO3 , 故化学方程式为:NH3+HNO3=NH4NO3 , 所以答案是:NH3+HNO3=NH4NO3;(5)在C中,将NO和空气、水混合后,NO和O2和水反应生成HNO3 , 其中氧气做氧化剂,所以答案是:利用空气中的氧气将NO氧化.
4NO+6H2O;(4)在D中,NH3和HNO3反应生成NH4NO3 , 故化学方程式为:NH3+HNO3=NH4NO3 , 所以答案是:NH3+HNO3=NH4NO3;(5)在C中,将NO和空气、水混合后,NO和O2和水反应生成HNO3 , 其中氧气做氧化剂,所以答案是:利用空气中的氧气将NO氧化.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下;

相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是______________________。
(2)反应①和②分别在装置_________________和 __________________中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是____________,优点是用量少,缺点是_____________。
(4)反应②为________________(填“放热”或“吸热”)反应。反应温度控制在50~60℃,温度过高的安全隐患是_______________________。
(5)中和釜D中加入的Z最适宜的是________________________(填编号。已知苯酚是一种弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸馏塔F中的馏出物T和P分别为___________和_____________,判断的依据是__________________。
(7)用该方法合成苯酚和丙酮的优点是____________________________。

