题目内容
【题目】在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 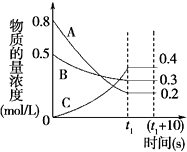
(1)该反应的化学方程式为 .
(2)0~t1 s内A气体的反应速率为 .
(3)反应后与反应前的压强之比为 .
(4)(t1+10)s时,A气体的体积分数为 , 此时v(A)正v(B)逆(填“>”、“<”或“=”).
(5)关于该反应的说法正确的是 .
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率.
【答案】
(1)3A+B?2C
(2)![]() ?mol?L﹣1?s﹣1
?mol?L﹣1?s﹣1
(3)9:13
(4)![]() ;>
;>
(5)bc
【解析】解:(1.)根据图知,随着反应的进行,A、B的浓度降低、C的浓度升高,则A和B是反应物、C是生成物,△c(A)=(0.8﹣0.2)mol/L=0.6mol/L,△c(B)=(0.5﹣0.3)mol/L=0.2mol/L,△c(C)=(0.4﹣0)mol/L=0.4mol/L,同一可逆反应中,同一时间段内各物质浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,所以该反应方程式为3A+B2C,所以答案是:3A+B2C;
(2.)0~t1 s内A气体的反应速率= ![]() =
= ![]() molL﹣1s﹣1 , 所以答案是:
molL﹣1s﹣1 , 所以答案是: ![]() molL﹣1s﹣1;(3.)恒温、恒容条件下,物质的量之比等于其压强之比,还等于其物质的量浓度之和之比,反应前气体浓度之和为(0.8+0.5)mol/L=1.3mol/L,反应后混合气体浓度之和=(0.4+0.3+0.2)mol/L=0.9mol/L,所以反应后与反应前的压强之比=0.9mol/L:1.3mol/L=9:13,所以答案是:9:13;
molL﹣1s﹣1;(3.)恒温、恒容条件下,物质的量之比等于其压强之比,还等于其物质的量浓度之和之比,反应前气体浓度之和为(0.8+0.5)mol/L=1.3mol/L,反应后混合气体浓度之和=(0.4+0.3+0.2)mol/L=0.9mol/L,所以反应后与反应前的压强之比=0.9mol/L:1.3mol/L=9:13,所以答案是:9:13;
(4.)体积分数之比等于物质的量浓度之比=0.2mol/L:(0.4+0.3:0.2)mol/L= ![]() ;同一物质的平衡状态正逆反应速率相等,但不同物质的反应速率之比等于其计量数之比,所以v(A)正>v(B)逆 , 所以答案是:
;同一物质的平衡状态正逆反应速率相等,但不同物质的反应速率之比等于其计量数之比,所以v(A)正>v(B)逆 , 所以答案是: ![]() ;>;
;>;
(5.)a.到达t1时刻正逆反应速率相等,但该反应为动态平衡状态,不停止,故错误;b.在t1时刻之前,该反应向正反应方向移动,所以正反应速率大于逆反应速率,则B气体的消耗速率大于它的生成速率,故正确;c.在t1时刻达到平衡状态,则C气体的正反应速率等于逆反应速率,故正确;
故选bc.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案