题目内容
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为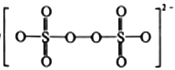 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。
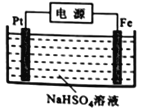
①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
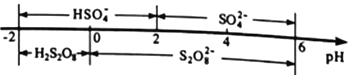
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
【答案】 +6 MnO4- 1:10 HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4 ![]() (或
(或![]() 或
或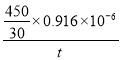 ) 负 0- 2 2HSO4--2e-= S2O82-+2H+ 重结晶
) 负 0- 2 2HSO4--2e-= S2O82-+2H+ 重结晶
【解析】(1)S2O82-的结构式为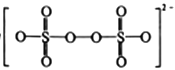 ,每个硫与4个O原子形成6个共价键,其中S元素的化合价为+6。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是 MnO4- 。(2)①脱硫过程中,当氨吸收液的pH=6时,HSO3-
,每个硫与4个O原子形成6个共价键,其中S元素的化合价为+6。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是 MnO4- 。(2)①脱硫过程中,当氨吸收液的pH=6时,HSO3-![]() SO32-+H+,Ka2=c(SO32-)c(H+)/c(HSO3-)=1.0×10-7,n(SO32-)∶n(HSO3-) =1:10。②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,K2S2O8作氧化剂,还原成H2SO4 ,第2步反应的化学方程式为HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4 ;80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率为0.916,NO去除的平均反应速率:v(NO) =
SO32-+H+,Ka2=c(SO32-)c(H+)/c(HSO3-)=1.0×10-7,n(SO32-)∶n(HSO3-) =1:10。②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,K2S2O8作氧化剂,还原成H2SO4 ,第2步反应的化学方程式为HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4 ;80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率为0.916,NO去除的平均反应速率:v(NO) =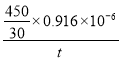 mol·L-1·min-1;(3)①电解时,铁作阴极,铁电极连接电源的负极。②常温下,在阳极放电的离子主要是HSO4-,电解HSO4-生成S2O82-,由图HSO4-存在的pH范围-2~2,S2O82-存在的pH范围0-2,阳极区电解质溶液的pH范围为0-2;S化合价不变,O由-2升高至-1价,失电子,阳极的电极反应式为 2HSO4--2e-= S2O82-+2H+ 。
mol·L-1·min-1;(3)①电解时,铁作阴极,铁电极连接电源的负极。②常温下,在阳极放电的离子主要是HSO4-,电解HSO4-生成S2O82-,由图HSO4-存在的pH范围-2~2,S2O82-存在的pH范围0-2,阳极区电解质溶液的pH范围为0-2;S化合价不变,O由-2升高至-1价,失电子,阳极的电极反应式为 2HSO4--2e-= S2O82-+2H+ 。
③往电解产品过二硫酸钠中加入硫酸钾,使其转化为过二硫酸钾粗产品,依据两者的溶解度差异,提纯粗产品的方法用重结晶的方法。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案