题目内容
3.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 在0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-) | |
| B. | 在0.1mol/L Na2CO3溶液中:2c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 物质的量浓度相等的CH3COOK和CH3COOH溶液中,溶液显酸性:c(CH3COO-)>c(CH3COOH) | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>②>③ |
分析 A.根据碳酸氢钠溶液中的电荷守恒分析;
B.根据碳酸钠溶液中的物料守恒判断;
C.混合液呈酸性,说明醋酸根离子的水解程度小于醋酸的电离程度;
D.硫酸氢铵中氢离子抑制了铵根离子的水解,碳酸氢铵中碳酸氢根离子促进了铵根离子的水解.
解答 解:A.在0.1mol/L NaHCO3溶液中,根据电荷守恒可知:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.在0.1mol/L Na2CO3溶液中,根据物料守恒可得:c(Na+)═2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.物质的量浓度相等的CH3COOK和CH3COOH溶液中,溶液显酸性,说明醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),故C正确;
D.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,①中氢离子抑制了铵根离子的水解,该溶液中铵根离子浓度最大,②中碳酸氢根离子促进了铵根离子的水解,其溶液中铵根离子浓度最小,则溶液中c(NH4+)的大小为:①>③>②,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,注意掌握判断离子浓度大小的常用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
13.已知:酸性H2CO3>HClO>HCO${\;}_{3}^{-}$,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | c(HCO${\;}_{3}^{-}$)>c(ClO-)>c(OH-) | |
| C. | c(HClO)+c(ClO-)=c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(ClO-)+c(OH-)+c(CO${\;}_{3}^{2-}$) |
8.乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产.回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式C2H4+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g)?C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)

①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=0.07(MPa)-1(Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(3)若某温度下,反应C2H4(g)+H2O(g)?C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示.
则v(正)<v(逆)(填“>”“<”“=”).
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式C2H4+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g)?C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)

①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=0.07(MPa)-1(Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(3)若某温度下,反应C2H4(g)+H2O(g)?C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示.
| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
15.向密度为d g•cm-3的盐酸中逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为( )
| A. | 25.4d mol•L-1 | B. | 12.7d mol•L-1 | C. | 6.97d mol•L-1 | D. | 6.35d mol•L-1 |
12.某烃的结构简式为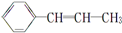 ,它可能具有的性质是( )
,它可能具有的性质是( )
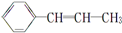 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 1 mol该烃含有4 mol碳碳双键 | |
| C. | 能发生聚合反应,其产物可表示为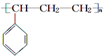 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
13.下列比较不正确的是( )
| A. | 非金属性:C>N | B. | 酸性:HClO4>H2CO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性H2O>H2S |
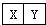 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族. ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.