题目内容
8.乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产.回答下列问题:(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式C2H4+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g)?C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)

①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=0.07(MPa)-1(Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(3)若某温度下,反应C2H4(g)+H2O(g)?C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示.
| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
分析 (1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),效仿乙酸乙酯水解,将水分成氢原子和羟基生成乙醇和硫酸;
(2)①列出Kp表达式,利用三段法计算平衡分压带入表达式计算即可;
②在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)可知正反应为气体体积减小的反应,根据压强对平衡移动的影响分析;
(3)比较Qp与Kp的大小,来判断正逆反应速率的大小.
解答 解:(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),化学方程式为C2H4+H2SO4=C2H5OSO3H,硫酸氢乙酯水解生成乙醇和硫酸,化学方程式为C2H5OSO3H+H2O→C2H5OH+H2SO4,
故答案为:C2H4+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4;
(3)①C2H4(g)+H2O(g)═C2H5OH(g)
开始:1 1 0
转化:0.2 0.2 0.2
平衡:0.8 0.8 0.2
乙醇占$\frac{0.2}{0.8+0.8+0.2}$=$\frac{1}{9}$,乙烯和水各占$\frac{0.8}{0.8+0.8+0.2}$=$\frac{4}{9}$,则乙醇的分压为7.85MPa×$\frac{1}{9}$=0.87MPa,乙烯和水的分压为7.85MPa×$\frac{4}{9}$=3.49MPa,
所以Kp=$\frac{p({C}_{2}{H}_{5}OH)}{p({C}_{2}{H}_{4})•p({H}_{2}O)}$=$\frac{0.87MPa}{3.49MPa×3.49MPa}$=0.07(MPa)-1,
故答案为:0.07(MPa)-1;
②在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4,
故答案为:p1<p2<p3<p4;反应分子数减少,相同温度下,压强升高乙烯转化率提高;
(3)比较Qp=$\frac{8.00MPa×0.5}{8.00MPa×0.25×8.00MPa×0.25}$=1(MPa)-1>Kp,所以平衡逆向移动,即v(正)<v(逆),故答案为:<.
点评 本题考查了化学方程式的书写、压强对平衡移动的影响、平衡常数的计算等知识,综合性非常强,该题是高考中的常见题型,属于中等难度较大,侧重于学生分析问题、解决问题、知识迁移能力的培养.

| A. | 钠的熔、沸点低 | |
| B. | 钠的颜色是银白色的 | |
| C. | 钠与空气中氧气反应,条件不同产物不同 | |
| D. | 因为反应要加热,所以该反应是吸热反应 |
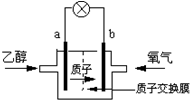 美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-═H2O | |
| D. | 电池工作时1mol乙醇被氧化时就有6mol电子转移 |
| A. | 两种气体质量相等 | B. | 两种气体的物质的量之比为16:1 | ||
| C. | 两种气体压强比为16:1 | D. | 两种气体体积比为1:16 |
| A. | 在0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-) | |
| B. | 在0.1mol/L Na2CO3溶液中:2c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 物质的量浓度相等的CH3COOK和CH3COOH溶液中,溶液显酸性:c(CH3COO-)>c(CH3COOH) | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>②>③ |
(1)既不是电解质,也不是非电解质的是F(或铁).
(2)纯碱的电离方程式是Na2CO3=2Na++CO32-.
(3)烧碱溶液与稀硫酸混合,发生反应的离子方程式为H++OH-=H2O.
(4)将干冰升华后所得的气体通入过量烧碱溶液中,发生反应的离子方程式为
CO2+2OH-=CO32-+H2O.
(5)a、b、c、d是Na2CO3、BaCl2、HCl、AgNO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
②写出a+c反应的离子方程式Ag++Cl-=AgCl↓.
盐酸分子式:HCl相对分子质量:36.5密度:1.19g/cm3质量分数:36.5%
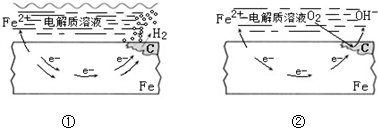
| A. | ①、②中的Fe都发生的是还原反应 | |
| B. | ①表面的电解质溶液可以为NaCl溶液 | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
| A. | 食醋 | B. | 食盐水 | C. | 啤酒 | D. | 茶水 |