题目内容
13.已知:酸性H2CO3>HClO>HCO${\;}_{3}^{-}$,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | c(HCO${\;}_{3}^{-}$)>c(ClO-)>c(OH-) | |
| C. | c(HClO)+c(ClO-)=c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(ClO-)+c(OH-)+c(CO${\;}_{3}^{2-}$) |
分析 A.碳酸钠、碳酸氢钠在溶液中水解,溶液显示碱性,则c(OH-)>c(H+);
B.H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,由于水解程度较小,则氢氧根离子浓度较小;
C.混合液中满足物料守恒,根据混合液中的物料守恒进行判断;
D.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断.
解答 解:A.NaClO、NaHCO3都属于强碱弱酸盐,溶液呈碱性,则c(OH-)>c(H+),故A错误;
B.H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,由于水解程度较小,则离子浓度大小为c(HCO3- )>c(ClO-)>c(OH-),故B正确;
C.物质的量浓度相等的NaClO、NaHCO3混合溶液中,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故C错误;
D.由电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D错误;
故选B.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理及判断溶液中离子浓度大小的方法,明确电荷守恒、物料守恒、质子守恒的含义及应用方法.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
1.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④敞口放置的久置氯水 ⑤盐酸⑥用盐酸酸化的漂白粉溶液.
①氯气 ②液氯 ③新制氯水 ④敞口放置的久置氯水 ⑤盐酸⑥用盐酸酸化的漂白粉溶液.
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
8.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
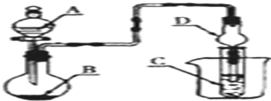

| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| C. | 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
18.钠在坩埚中燃烧不可以证明的是( )
| A. | 钠的熔、沸点低 | |
| B. | 钠的颜色是银白色的 | |
| C. | 钠与空气中氧气反应,条件不同产物不同 | |
| D. | 因为反应要加热,所以该反应是吸热反应 |
5.下列叙述正确的是( )
①足量锌跟一定量的稀硫酸反应时,加入少量硫酸铜溶液能加快反应速率且不影响产气量
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,可以电解熔融态的AlCl3
⑤钢铁表面常易锈蚀生成Fe2O3•nH2O.
①足量锌跟一定量的稀硫酸反应时,加入少量硫酸铜溶液能加快反应速率且不影响产气量
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,可以电解熔融态的AlCl3
⑤钢铁表面常易锈蚀生成Fe2O3•nH2O.
| A. | ②④ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
2.下列说法不正确的是( )
| A. | 利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响 | |
| B. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| C. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | 酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是酸碱两性物质 |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-) | |
| B. | 在0.1mol/L Na2CO3溶液中:2c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 物质的量浓度相等的CH3COOK和CH3COOH溶液中,溶液显酸性:c(CH3COO-)>c(CH3COOH) | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>②>③ |
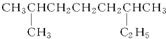 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;②乙醛与银氨溶液水浴加热CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O;
;②乙醛与银氨溶液水浴加热CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O;